
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
⑴ 比较下列两组物质的熔点高低(填>或<)
SiC______ Si; SiCl4 ______ SiO2
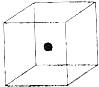
⑵ 图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g)  Si(s) + 4HCl(g)
Si(s) + 4HCl(g)
该反应的反应热△H = ___________ KJ/mol
【答案】
⑴ > <
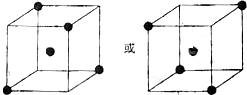
⑵ 如下图
⑶ +236
【解析】本题主要考查键能的大小与物质性质及反应热之间的关系。
(1)SiC与Si皆为原子晶体,由于Si—C键能大于Si—Si键能,故SiC的熔点比Si高;SiCl4为分子晶体,SiO2为原子晶体,前者的熔点低于后者。
(2)根据硅原子与硅原子可形成四 个相等的硅硅键可知除立方体中心的硅原子处,与它相邻的硅原子应
个相等的硅硅键可知除立方体中心的硅原子处,与它相邻的硅原子应 处于可形成正四面体的四个顶点上。
处于可形成正四面体的四个顶点上。
(3)根据题意所给反应的旧化学键键能之和为:4×360 kJ·mol-1+2×436 kJ·mol-1=2312 kJ·mol-1,新化学键键能之和为4×431 kJ·mol-1+2×176 kJ·mol-1(每摩硅原子相当于形成2 mol
Si—Si)=2 076 kJ·mol-1,所以反应热为:2312 kJ·mol-1-2076 kJ·mol-1=236 kJ·mol-1。


科目:高中化学 来源: 题型:
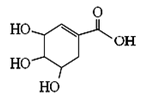
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
A.分子式为C7H6O5
B.分子中含有两种官能团
C.可发生加成和取代反应
D.分子中有7个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B.1∶3 C.1∶4 D.2∶3
1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol
(2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于
A.-317.3kJ/mol B. -379.3kJ/mol
-379.3kJ/mol
C.-332.8 kJ/mol D.317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g) 2SO3(g).
2SO3(g).
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
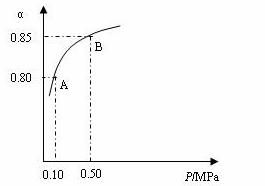
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
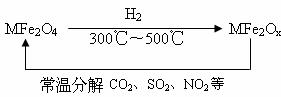
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.元素周期表中的ⅠA族和ⅦA族元素间所形成的化学键可能是共价键也可能是离子键
B.H—O键键能为463KJ∕mol,即1molH2O分解成H2和O2时,消耗能量为2×463KJ
C.分子中键能越大,键长越长,则分子越稳定
D.水分子可表示为H—O—H,分子中键角为180°
查看答案和解析>>
科目:高中化学 来源: 题型:
用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
A.形成较多的白色沉淀 B.排除SO42-以外的其它阴离子及Ag+的干扰
C.形成的沉淀纯度更高 D.排除Ba2+以外的其它阳离子的干扰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com