
过氧化钙(CaO2)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.实验室
可用钙盐制取CaO2·8H2O,再经脱水制得CaO2.CaO2·8H2O不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水CaO2.其制备过程如下: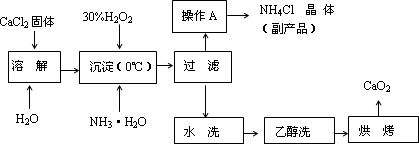
根据以上信息,回答下列问题:
(1)写出制取
CaO2·8H2O的化学方程式是________.(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是________.
(3)操作A的步骤为________.
(4)检验“水洗”已经洗净的方法是________.
(5)测定含杂质的产品中
CaO2含量的实验步骤是:(己知:①CaO2在酸性条件下将I-氧化为I2 ②I2+2S2O32-→2I-+S4O62- ③杂质不与I-反应)
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入适量2 mol/L的盐酸,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL.
①第三步反应完全时的现象为________.
②产品中CaO2的质量分数为________.(用字母表示)
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的
CaO2的质量分数偏高(测定过程中由操作产生的误差忽略不计),可能的原因是________.科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012届安徽省蚌埠市三年级第一次教学质量检查考试化学试卷(解析版) 题型:填空题
(11分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气, 因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铝)等为原料制取过氧化钙(CaO2)的流程。
请回答下列问题:
(1)①中实验操作顺序为 (填序号)。
a.过滤 b.蒸馏 C.分液 d.蒸发结晶
(2)用氨水调节pH至7~8的目的是 。
(3)写出生成滤渣B的离子方程式 。
(4)若在滤液C中,加入HNO3,使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(N03-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式 。一段时间后,再加入氢氧化钠溶液,调节溶液的pH至9~11, 出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~ll的原因 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省荆州市高三毕业班质量检查(Ⅰ)化学试卷(解析版) 题型:选择题
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
A. CaO2具有氧化性,对面粉可能具有增白作用
B. CaO2中阴阳离子的个数比为1:1
C. CaO2和水反应时,每产生1 mol O2转移电子4 mol
D. CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源:2014届安徽省桐城市高二下学期期末考试化学试卷(解析版) 题型:实验题
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:

(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省天长市高二下学期月考化学试题 题型:选择题
卫生部宣布从2011年5月1日起,禁止在面粉生产中添加“面粉增白剂”——过氧化苯甲酰(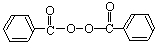 )和过氧化钙(CaO2)。下列关于“面粉增白剂”的说法不正确的是(
)
)和过氧化钙(CaO2)。下列关于“面粉增白剂”的说法不正确的是(
)
A.过氧化苯甲酰是有机物,过氧化钙是无机物
B.过氧化苯甲酰和过氧化钙中均含有过氧键、离子键
C.过氧化苯甲酰和过氧化钙均能使品红溶液褪色
D.过氧化苯甲酰熔点比过氧化钙熔点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com