
| A. | AlCl3(aq) | B. | Al2(SO4)3(aq) | C. | HCl(aq) | D. | NaHCO3(aq) |
分析 溶液加热蒸干后,能析出原溶质固体的,需要溶质性质稳定,不分解、不能被氧化、不能水解或水解程度不大,据此分析.
解答 解:A、AlCl 3(aq)中存在下列平衡AlCl3+3H2O?Al(OH)3+3HCl;△H>0加热蒸发时,平衡向右移动,HCl比水还易挥发C不可选,同时生成的Al(OH) 3部分分解:2Al(OH)3$\frac{\underline{\;加热\;}}{\;}$Al2O3+3H2O↑,最后得到Al2O3,故A错误;
B、Al2(SO4)3(aq)中也存在水解平衡:Al2(SO4)3+6H2O?2Al(OH)3+3H2SO4;△H>0,加热蒸发时,平衡也向右移动水解反应吸热,但H2SO4难挥发.随着水分的蒸发,溶液中H2SO4浓度的增大,上列平衡又会向左移动,最终溶液蒸干,得到Al2(SO4)3固体,故B正确;
C、盐酸是挥发性酸,在加热时,HCl会挥发,故加热蒸发后什么都得不到,故C错误;
D、碳酸氢盐热稳定性差,在水溶液中更不稳定.加热蒸发NaHCO3(aq)时,2NaHCO3 Na2CO3+H2O+CO2↑最终得到Na2CO3固体,故D错误.
Na2CO3+H2O+CO2↑最终得到Na2CO3固体,故D错误.
故选B.
点评 本题考查盐类水解知识,题目难度不大,注意把握物质的稳定性和水解的性质,易错点为C,注意硫酸盐水解的特点.


科目:高中化学 来源: 题型:解答题
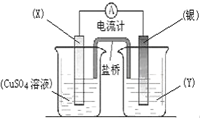 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO(g)+H2(g).
CO(g)+H2(g).| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
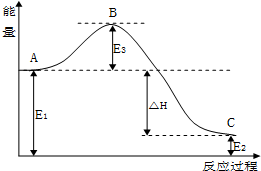
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 对于吸收能量的反应必需加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
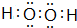 .
.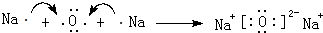 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
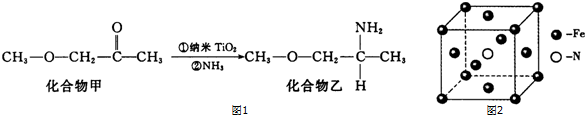
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| B. | 所有化学变化的能量都可以通过原电池转化为电能 | |
| C. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| D. | 凡是需要加热的反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稳定性:A2D<A2X | |
| B. | CA3分子的立体结构为平面三角形 | |
| C. | C形成的单质中σ键与π键个数之比为1:2 | |
| D. | B、C、D形成的气态氢化物互为等电子体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: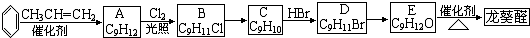
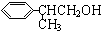 +O2
+O2
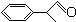 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com