
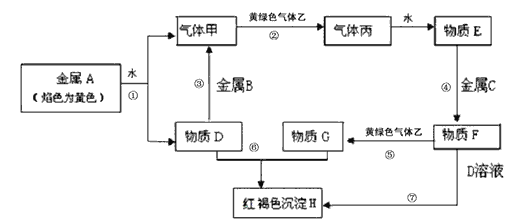
����Ŀ�����н�������A��B��C������ס��ҡ���������D��E��F��G��H������֮���ܷ������·�Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������
�����������Ϣ�ش��������⣺
��1��д���������ʵĻ�ѧʽ��A��_____ B��_____ F��______ ����______
��2��˵������ɫ�����ҵ�һ����;��____________________��
��3������ȥF��Һ�к��е�����G�������______��ʵ���Ҽ���G�������Ľ�������ʱ������G����Һ�м���_______________��Һ��
��4����Ӧ�ٵ����ӷ���ʽΪ_______________________________________��
��5����Ӧ���漰�Ļ�ѧ����ʽ��____________________________________��
���𰸡� Na Al FeCl2 HCl ����ˮ�������߹�ҵ������ Fe�� KSCN��Һ��NaOH��Һ 2Na+2H2O=2Na+ + 2OH- +H2�� FeCl2+2NaOH=Fe(OH)2��+2NaCl��4Fe(OH)2+O2+2H2O==4Fe(OH)3
������������A��ɫ��ӦΪ��ɫ����AΪ����Na���ɷ�Ӧ�ٿ�֪��DΪNaOH�������ΪH2���������������B��Ӧ�����������ʽ���BΪAl����������������G��Ӧ���ɺ��ɫ����H��Fe(OH)3��������G�к���Fe3+������ɫ����������������������Ӧ�����Ȼ��⣬�����Ȼ��⣬����ˮ�õ�E�����ᣬ����������Ӧ�����Ȼ��������Ȼ��������������������Ȼ������Ȼ��������������Ʒ�Ӧ����������������������CΪFe������FΪFeCl2������GΪFeCl3��HΪ������������
��1����������ķ�����֪��A��B��F�����ֱ���Na��Al��FeCl2��HCl����2����Ϊ������������������ˮ���������������3��FΪ�Ȼ�������GΪ�Ȼ�������ȥF��Һ�к��е�����G����������ۣ�ʵ���Ҽ���G�������Ľ�������ʱ������G����Һ�м���KSCN��Һ��NaOH��Һ����4����Ӧ�ٵ����ӷ���ʽΪ2Na+2H2O=2Na+ + 2OH�� +H2������5����Ӧ��Ϊ�Ȼ��������������Ʒ�Ӧ����Ӧ������������������������������������������������������������Ӧ�Ļ�ѧ����ʽΪFeCl2+2NaOH��Fe(OH)2��+2NaCl��4Fe(OH)2+O2+2H2O��4Fe(OH)3��


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ�����Ư���Ե��ǣ� ��
A.�������B.��84������ҺC.����D.������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����mgþ�����Ļ�����м���������ϡ���ᣬǡ����ȫ��Ӧ���ɱ�״���µ�����bL����Ӧ�����Һ�м���cmol/L����������ҺVmL��ʹ�������Ӹպó�����ȫ���õ��ij�������Ϊng���ٽ��õ��ij����������������ٸı�Ϊֹ���õ�����pg�������й�ϵ����ȷ���ǣ� ��
A. n��17Vc��m B. 5m/3��p��17m/9
C. p��m+cV/125 D. c=1000b/11.2V
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
�� | �� | �屽 | |
�ܶ�/gcm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
��ش��������⣺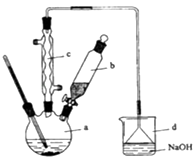
��1����a�м���15mL��ˮ����������м����b��С�ļ���4.0mLҺ̬�壮��a�е��뼸���壬�а�ɫ��������������Ϊ���������壮�����μ���Һ����꣮װ��d����������
��2��Һ�����������в�������ᴿ��
����a�м���10mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӣ�NaOH��Һϴ�ӵ���������
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˣ������Ȼ��Ƶ�Ŀ������
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ �� Ҫ��һ���ᴿ�����в����б��������������ȷѡ��ǰ����ĸ����
A���ؽᾧ B������ C������ D����ȡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������Y���γɵ�һ�ֵ����ж�������ȼ�������жϲ���ȷ���ǣ� �� ![]()
A.��������ϼۣ�X��Y��Z��W
B.ԭ�Ӱ뾶��W��Z��Y
C.��̬�⻯������ȶ��ԣ�Y��Z��W
D.����������Ӧˮ��������ԣ�X��Y��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3���ִ���ҵ������Ӧ�ù㷺�����������ϵ�֪����ˮFeCl3�ڿ������׳��⣬��������������ҵ�ϣ���500��600�����м��ͨ��������������ˮ�Ȼ������������м��ͨ���Ȼ������������ˮ�Ȼ�������ij��ѧ�о���ѧϰС��ģ�ҵ���������Ʊ���ˮFeCl3���Բ���������ͼ̽��ʵ�飬��ش��������⣺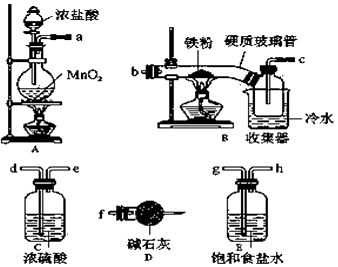
��1��װ�õ�����˳��Ϊa�� �� �� �� ��b��c�� ��
��2��i��A�з�Ӧ�����ӷ���ʽ�� ��
ii��D�м�ʯ�ҵ������� ��
��3����Ӧ���������ɵ���״FeCl3�ֽ����ռ��������������ڷ�Ӧ��B��Ӳ�ʲ����ܵ��Ҷˣ�Ҫʹ������FeCl3�����ռ���������еIJ����� ��
��4����Ӧһ��ʱ���Ϩ��ƾ��ƣ���ȴ��Ӳ�ʲ����ܼ��ռ����е�����һ������ת������ƿ�У��������ϡ���������ֲ���ͣ���Ӧ�����в�������ַ�Ӧ��������ʵ�飺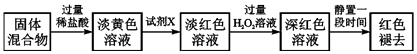
�ٵ���ɫ��Һ�м����Լ�X���ɵ���ɫ��Һ�����ӷ���ʽΪ ��
�ڵ���ɫ��Һ�м������H2O2����Һ��ɫ�����ԭ�����������ӷ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���ǣ� ��
A.SO2��Ħ��������64g
B.18g H2O�ڱ�״���µ������22.4L
C.�ڱ�״���£�20mL NH3 ��60mL O2�����ķ�������Ϊ1��3
D.��40g NaOH����1Lˮ�У�������Һ�����ʵ���Ũ��Ϊ1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥKCl��Һ�к��е�����K2SO4���ʵõ�����KCl��ѡ�õ�����Լ���˳��Ϊ��������
��BaCl2 ��Ba(NO3)2 ��K2CO3 ��Na2CO3 ��HCl ��HNO3
A.�٢�B.�٢ۢ�C.�ڢۢ�D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£������ͬ��pH��Ϊ3�Ĵ���������˵����ȷ���ǣ� ��
A.�ֱ��������пƬ��������Һ����H2�������ͬ
B.�ֱ��ˮϡ��100����������Һ��pH����ͬ
C.�����е�c��CH3COO�����������е�c��SO ![]() �����
�����
D.������Һ�У���ˮ�������������Ũ�Ⱦ�Ϊ1��10��11 mol?L��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com