
【题目】FeCl3在现代工业生产中应用广泛.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.工业上,向500﹣600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁.某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如图探究实验,请回答下列问题: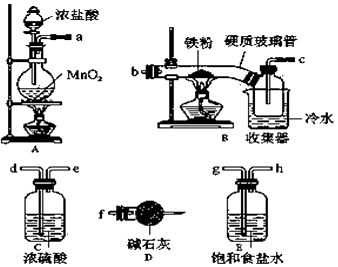
(1)装置的连接顺序为a→ , → , →b,c→ .
(2)i.A中反应的离子方程式: .
ii.D中碱石灰的作用是 .
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端.要使沉积的FeCl3进入收集器,需进行的操作是 .
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验: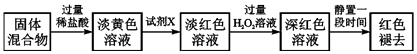
①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为 .
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是(用离子方程式表示).
【答案】
(1)g,h,d,e,f
(2)MnO2+2Cl﹣+4H+ ![]() Mn2++2H2O+Cl2↑,吸收没有反应完的氯气,以防污染空气,吸收空气中的水蒸气,防止生成的FeCl3潮解
Mn2++2H2O+Cl2↑,吸收没有反应完的氯气,以防污染空气,吸收空气中的水蒸气,防止生成的FeCl3潮解
(3)在沉积的FeCl3固体下方加热
(4)Fe3++3SCN﹣?Fe(SCN)3,2Fe2++2H++H2O2═2Fe3++2H2O
【解析】解:(1)浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→d→e→b→c→f;
(2)i.制取无水氯化铁的实验中,A装置制取的是氯气,实验室常用浓盐酸与二氧化锰加热制取,离子方程式为:MnO2+2Cl﹣+4H+ ![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
ii.D中碱石灰的作用是吸收多余污染气体,防止空气中水蒸气进入装置B,吸收没有反应完的氯气,以防污染空气,吸收空气中的水蒸气,防止生成的FeCl3潮解;
(3)无水FeCl3在空气中易潮解,加热易升华,反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端.要使沉积得FeCl3进入收集器,需进行的操作是在沉积的FeCl3固体下方加热;
(4)①Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,反应方程式为Fe3++3SCN﹣Fe(SCN)3;
②Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN﹣反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,反应的离子方程式为:2Fe2++2H++H2O2═2Fe3++2H2O;
所以答案是:(1)g;h;d;e;f;(2)i.MnO2+2Cl﹣+4H+ △ _ Mn2++2H2O+Cl2↑;ii.吸收没有反应完的氯气,以防污染空气;吸收空气中的水蒸气,防止生成的FeCl3潮解;(3)在沉积的FeCl3固体下方加热;(4)①Fe3++3SCN﹣Fe(SCN)3;②2Fe2++2H++H2O2═2Fe3++2H2O.


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.正常雨水的pH为7.0,酸雨的pH小于7.0
B.严格执行机动车尾气排放标准有利于防止大气污染
C.使用二氧化硫和某些含硫化合物漂白食品会对人体健康产生危害
D.使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)═2CO2(g)△H=﹣565.2kJmolˉ1 , 下列说法不正确的是( )
A.CO(g)+ ![]() O2(g)═CO2(g)△H=﹣282.6 kJ?molˉ1
O2(g)═CO2(g)△H=﹣282.6 kJ?molˉ1
B.2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
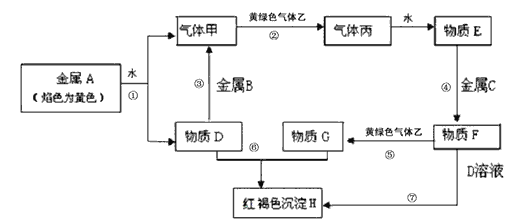
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A:_____ B:_____ F:______ 丙:______
(2)说出黄绿色气体乙的一种用途:____________________。
(3)若除去F溶液中含有的少量G,需加入______,实验室检验G中所含的金属离子时,常在G的溶液中加入_______________溶液。
(4)反应①的离子方程式为_______________________________________。
(5)反应⑦涉及的化学方程式有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组制备氢氧化亚铁沉淀。
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
(1)实验1中产生白色沉淀的离子方程式是________________。
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
① 甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有 Fe(OH)3,方案是__________。
② 乙同学查阅文献:Fe(OH)2在大量SO42存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入_____________,再往试管中加入____________,振荡,现象与实验1相同,结论是该假设不成立。
③ 乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10 mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
实验2 | 6 mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色) ,沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6 mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色) ,沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是_______________,能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是____________。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是________________,证明该假设成立。
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为_____________。
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1molL﹣1 NaOH溶液中逐滴加入0.1molL﹣1的一元酸HA,溶液pH的变化曲线如图所示. 
(1)酸碱中和滴定时,用到的仪器有酸式滴定管、碱式滴定管、铁架台(带蝴蝶夹)、 .
(2)a点(横坐标为10)所示溶液中,溶质是 , 溶液中c(Na+)、c(A)、c(H+)、c(OH﹣)从大到小的顺序为 , 其中c(Na+)c(A﹣)+c(HA)(填“>”“<”或“=”)
(3)c点所示溶液中,c(Na+)c(A﹣)(填“>”“<”或“=”)
(4)b点所示溶液中,c(A﹣)c(HA)(填“>”“<”或“=”)
(5)a、b、c点所示溶液中,水的电离程度最大的是 .
(6)以下滴定操作会导致V(HA)偏大的是 . A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、最后一滴HA溶液附在锥形瓶内壁上未冲下
E、滴定开始前读数时平视,滴定终点,读数时俯视.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图下4种碳架的烃,则下列判断正确的是( ) ![]()
A.a和d是同分异构体
B.b和c不是同系物
C.a和d都能发生加成反应
D.只有b和c能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2经一系列过程可以得到HNO3和NH4HCO3,如下图所示。

(1)过程 ______ 属于“氮的固定”。
(2)过程Ⅱ,NH3和O2在催化剂作用下反应,其化学方程式是________。
(3)过程Ⅳ,为使NO2尽可能多地被水吸收,需不断的向反应器中通入________。
(4)NH4HCO3常用作铵态氮肥,但不宜在碱性较强的土壤中施用,原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com