
 CO2��H2�ϳɼ��ѵ���Ҫ��Ӧ���£�
CO2��H2�ϳɼ��ѵ���Ҫ��Ӧ���£����� ��1����֪����2CO2��g��+6H2��g��?CH3CH2OH��g��+3H2O��l����
1molCH3CH2OH��g����ȫȼ�յ��Ȼ�ѧ����ʽΪ��CH3CH2OH��g��+3O2��g��=2CO2��g��+3H2��l����
6molH2��g����ȫȼ�յ��Ȼ�ѧ����ʽΪ��6H2��g��+3O2��g��=6H2O��l������+��=�ۣ�6molH2��g����ȫȼ�շų��������ࣻ�Ҵ���C-C�ļ��ܸ��ݷ�Ӧ��=��Ӧ���ܼ���-�������ܼ��ܼ��㣻
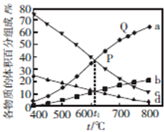
��2���ٷ�Ӧ���Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ������CO2��H2�����������Ӧa��b��CH3CH2OH��3H2O�����������С����Ӧc��d���ٸ��ݺ����ɵã�
���¶ȸߣ���Ӧ���ʿ죻
��t1��ʱ��������ˮ�����������ȣ��跴Ӧ������̼2x����������ʽ���㣬����ƽ�ⳣ�����㣻
��3��CO2��H2�ϳɼ��ѵķ�ӦΪ��2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g��������ѹǿ�Է�Ӧ��Ӱ������ɵã�
��� �⣺��1����֪����2CO2��g��+6H2��g��?CH3CH2OH��g��+3H2O��l����
1molCH3CH2OH��g����ȫȼ�յ��Ȼ�ѧ����ʽΪ��CH3CH2OH��g��+3O2��g��=2CO2��g��+3H2��l����
6molH2��g����ȫȼ�յ��Ȼ�ѧ����ʽΪ��6H2��g��+3O2��g��=6H2O��l������+��=�ۣ��١��ھ�Ϊ���ȷ�Ӧ����6molH2��g����ȫȼ�շų��������ࣻ
���Ҵ���C-C�ļ���Ϊx����CH3CH2OH��g��?CH3OCH3��g����H2=413��5+x+343+465-6��413-2��343=+50.7�����x=341.7��
�ʴ�Ϊ���٣�341.7��
��2���ٷ�Ӧ���Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ������CO2��H2�����������Ӧa��b���������ĺ����ȶ�����̼�࣬��aΪ������bΪ������̼��CH3CH2OH��3H2O�����������С����Ӧc��d�����ɵ�ˮ���������࣬��cΪˮ��dΪCH3CH2OH��
�ʴ�Ϊ��H2��CO2��H2O��CH3CH2OH��
���¶ȸߣ���Ӧ���ʿ죬v����P����v����Q����
�ʴ�Ϊ������
���跴Ӧ������̼2x����
2CO2��g��+6H2��g��?CH3CH2OH��g��+3H2O��g��
nʼ��0.1 0.3 0 0
nת��2x 6x x 3x
nƽ��0.1-2x 0.3-6x x 3x
t1��ʱ��������ˮ�����������ȣ�˵��������ˮƽ��ʱ�����ʵ�����ͬ����0.3-6x=3x�����x=0.03����ѧƽ�ⳣ��K=$\frac{��3��0.03��^{3}��0.03}{��0.1-2��0.03��^{2}����0.3-6��0.03��^{6}}$=3��104��
�ʴ�Ϊ��3��104��
��3��CO2��H2�ϳɼ��ѵķ�ӦΪ��2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g�����÷�Ӧ�Ǹ�������������ٵĿ��淴Ӧ����ѹƽ�������ƶ�������ѹǿԽ��ƽ��ʱ���ѵİٷֺ���Խ�ߣ�
�ʴ�Ϊ���ߣ���Ӧ�Ǹ�������������ٵĿ��淴Ӧ����ѹƽ�������ƶ���
���� ���⿼���˸�˹���ɡ���Ӧ������ܵĹ�ϵ����ѧƽ����йؼ��㼰Ӱ�컯ѧƽ������أ��ۺ���ǿ��ѧ��ע����ջ�������㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2CO3?2H++CO32- | B�� | NaHSO4?Na++HSO4- | ||
| C�� | H2S+H2O?HS-+H3O+ | D�� | Ca��OH��2?Ca2++2OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe2O3+3CO $\frac{\underline{\;\;��\;\;}}{\;}$2 Fe+3CO2 | B�� | NH4NO3$\frac{\underline{\;\;��\;\;}}{\;}$N2O��+2H2O | ||
| C�� | 2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O | D�� | 4Fe ��OH��2+O2+2H2O�T4Fe��OH��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ����̿/mol | NO/mol | A/mol | B/mol | p/MPa | |
| 200�� | 2.00 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335�� | 2.005 | 0.050 | 0.0250 | 0.0250 | p |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
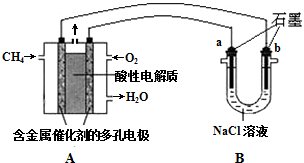
 �й��������ϵ�һ������������������������ҵ��ʽ��תֱ�£����ٸ�����ҵ����ȫ�����2015�꣬�������������34�������״��½���ԭ�������Ϊ��¯���������ͼ�����������߸���ֵ��Ʒ���������ѧ֪ʶ�ش��������⣺
�й��������ϵ�һ������������������������ҵ��ʽ��תֱ�£����ٸ�����ҵ����ȫ�����2015�꣬�������������34�������״��½���ԭ�������Ϊ��¯���������ͼ�����������߸���ֵ��Ʒ���������ѧ֪ʶ�ش��������⣺| Fe2O3 | CO | Fe | CO2 | |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
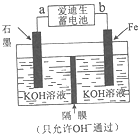
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�����Һ�ڵ��������µ������������������ | |
| B�� | ���ᱵ������ˮ�����ᱵ���ڵ���� | |
| C�� | ����ˮ���ܵ���������ӵĻ����ﶼ���� | |
| D�� | ˮ�ѵ��룬��ˮ���������磬����ˮһ�����ǵ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com