
 H2 + CO2 + Q
H2 + CO2 + Q
 ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д� ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2��g��+H2��g�����仯ѧƽ�ⳣ��K���¶�k�Ĺ�ϵ����
CO2��g��+H2��g�����仯ѧƽ�ⳣ��K���¶�k�Ĺ�ϵ���� ����
����| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
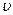 ����H2��=
����H2��=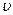 ����H2O�� ��d��c��CO2��=c��CO��
����H2O�� ��d��c��CO2��=c��CO���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NO2(g) ��H��0��
2NO2(g) ��H��0��| A���¶Ȳ��������С����Ӧ���������ٴ�ƽ��ʱ�������ɫ��dz |
| B���¶Ⱥ�������䣬��������NO2���ٴ�ƽ��ʱ�������NO2�İٷֺ������� |
| C���������ʱ��������N2O4���ٶ�ƽ��ʱ��ɫ���� |
| D���������ʱ�����¶ȣ��ٴ�ƽ��ʱ�������ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ������5
������5 ����D��Ũ��Ϊ
����D��Ũ��Ϊ ��C�ķ�Ӧ����Ϊ
��C�ķ�Ӧ����Ϊ ������˵���в���ȷ���ǣ� ��
������˵���в���ȷ���ǣ� ��A��5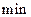 ĩ��A��Ũ��Ϊ ĩ��A��Ũ��Ϊ |
B��0-5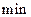 ʱ��B��ƽ����Ӧ����Ϊ ʱ��B��ƽ����Ӧ����Ϊ |
| C��B����ʼ���ʵ���Ϊ1.5mol |
| D��=2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)��ͬһѹǿ�±仯��ͼ������������ȷ����
pC(g)��ͬһѹǿ�±仯��ͼ������������ȷ����
| A��T1��T2����Ӧ�����ȷ�Ӧ | B��T1��T2����Ӧ�Ƿ��ȷ�Ӧ |
| C��T1��T2����Ӧ�����ȷ�Ӧ | D��T1��T2����Ӧ�Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H����CH3COO��������������������ƽ�ⲻ�����ƶ�����
H����CH3COO��������������������ƽ�ⲻ�����ƶ�����| A��NaCl���� | B��CH3COONa | C��Na2CO3 | D��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)+D(g)�Ѵﵽƽ��״̬���� ( )
C(g)+D(g)�Ѵﵽƽ��״̬���� ( )�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3C(g)��ֻ�з�Ӧ����ƽ��ʱ�ž��е�������
3C(g)��ֻ�з�Ӧ����ƽ��ʱ�ž��е��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3Z(g)����ʱ����X��Y��Z�����ʵ���֮��Ϊ 3:2:2��������˵��һ����ȷ���ǣ� ��
3Z(g)����ʱ����X��Y��Z�����ʵ���֮��Ϊ 3:2:2��������˵��һ����ȷ���ǣ� �� 
| A����X��Y��Ϊ��̬����ƽ��ʱ����ƽ��Ħ���������� |
| B����X��Y����Ϊ��̬����ƽ��ʱX�IJ��ʣ��� |
| C����X��Y��Ϊ��̬�������ʼ��ƽ������ʱ�䣺��>�� |
| D����XΪ��̬��YΪ��̬����ƽ������ڢ����ټ���1molZ������ƽ��ʱZ������������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com