
【题目】化学与生产、生活息息相关。下列叙述错误的是
A. 古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. Ba2+对人体无毒,故BaSO4在医学上可用作钡餐
C. 侯氏制碱法工业过程中应用了物质溶解度的差异
D. “煤改气”、“ 煤改电”等工程有利于减少雾霾
科目:高中化学 来源: 题型:
【题目】80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4![]() 2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:下列判断正确的是
2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:下列判断正确的是
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. 升高温度该反应的平衡常数K减小
B. 20~40 s 内,v(N2O4)=0.002 mol/L .s
C. 反应达平衡时,吸收的热量为0.30 Q kJ/mol
D. 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的说法正确的是:
A.已知C(石墨,s) ![]() C(金刚石,s) △H>0,说明金刚石比石墨稳定
C(金刚石,s) △H>0,说明金刚石比石墨稳定
B.已知H+(aq) + OH-(aq) = H2O(l) △H= -57.4kJ/mol,则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出热量小于28.7kJ
C.已知甲烷的燃烧热为890.3kJ/mol,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g) + 2O2 (g) = CO2(g) + 2H2O(g) △H= -890.3kJ/mol
D.将0.5molN2和1.5molH2置于密闭容器中充分反应达到平衡时,放出热19.3kJ的热量,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ/mol
2NH3(g) △H= -38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
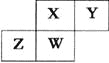
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)
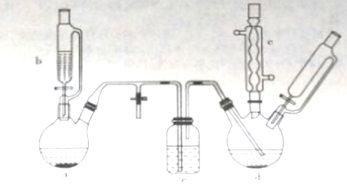
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是__________,用离子方程式表示产生该现象的原因:_______________。
(2)仪器b外侧玻璃导管的作用是_____________。
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是_________,其盛装的试剂名称是_____________。
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是____________。
(4)仪器c的作用是______________。
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如下表:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机物混合物中提取氯苯时,采用蒸馏的方法,收集_________℃作用的馏分。
(6)实际工业生产中,苯的流失如下表:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13t苯,则制得氯苯________t(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为 。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将 (填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系:Q3= 。
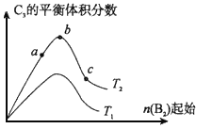
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4 molA2和2 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是 (填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com