
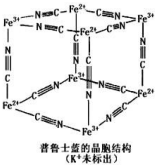
 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )| A. | 化学式可以表示为 KFe2(CN)6 | |
| B. | 每一个立方体中平均含有 24 个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个 Fe3+周围与之相邻的 Fe2+离子有 12 个 |
分析 A、利用均摊法计算普鲁士蓝化学式;
B、每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键;
C、普鲁士蓝中Fe3+与CN-形成配位键;
D、Fe3+周围的Fe2+离子在顶点上.
解答 解:A、每隔1个立方体中心有1个钾离子,所以1个晶胞中钾离子个数=1×$\frac{1}{2}$=0.5,该立方体中铁原子个数=$\frac{1}{8}$×8=1,CN-位于每条棱中点,该立方体中含有CN-个数=12×$\frac{1}{4}$=3,所以平均化学式是K 0.5 Fe(CN)3,化学式可以表示为KFe2(CN)6,故A正确;
B、每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键,故B错误;
C、普鲁士蓝中Fe3+含有空轨道,CN-中N原子提供孤电子对,形成配位键,属于配合物,故C错误;
D、普鲁士蓝中Fe3+周围Fe2+离子个数为3×8×$\frac{1}{8}$=3个,故D错误.
故选A.
点评 本题考查了晶胞的计算、配位键等知识点,难点是Fe3+周围与之相邻的 Fe2+数目,题目难度中等,侧重于考查学生的分析能力和计算能力.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 将铁片换成铁粉 | B. | 把稀硫酸换成浓硫酸 | ||
| C. | 加热 | D. | 加入少量CuO粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Na2S溶液中含有0.2NA个Na+ | |
| B. | 标准状况下,22.4L的H2O含有2NA个氢原子 | |
| C. | 常温下,44gCO2含有NA个氧原子 | |
| D. | 0.1molNa与足量O2反应生成Na2O,转移0.1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g14CH4所含中子数目为8NA | |
| B. | 标准状况下,7.8g苯中含碳碳双键的数目为0.3NA | |
| C. | 含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 | |
| D. | 5.6g铁粉在足量的氯气中充分燃烧,得到电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 . .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
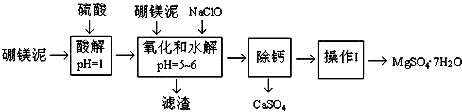
| 温度/℃ | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Cl2发生还原反应 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 脱氯反应后,溶液的酸性增强 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液的pH相同 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | 分别与等物质的量浓度、等体积的盐酸混合后,所得溶液都显中性 | |
| D. | 等体积的两溶液与硫酸完全反应,消耗硫酸的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com