
| A、950 mL;111.2 g |
| B、1000 mL;117 g |
| C、500 mL;117 g |
| D、1000 mL;111.2 g |
科目:高中化学 来源: 题型:
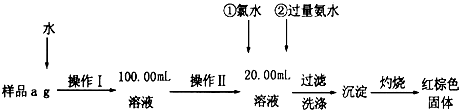
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径(10-10m) | 1.30 | 0.82 | 0.99 | 1.11 | 0.90 | 1.18 |
| 最高或最低化合价 | +2 | +3 | +7 | +4 | +2 | +3 |
| -1 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配置浓硫酸的酒精溶液时,要将酒精缓慢注入浓硫酸中,并充分搅拌 |
| B、用pH试纸测量某溶液的酸碱度时,必须先用水润湿pH试纸 |
| C、中和滴定实验中,眼睛要始终注视滴定管中液面的变化 |
| D、实验室做醛的银镜反应时,一般采用水浴加热混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | N-H | N-N | O=O | N≡N | O-H |
| 键能/KJ?mol-1 | 386 | 167 | 498 | 946 | 460 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com