
下列电离方程式错误的是( )
A.CaCl2=Ca2++2Cl﹣ B.Na2SO4=2Na++SO42﹣
C.HNO3=H++NO3﹣ D.KClO3=K++Cl﹣+3O2﹣
考点:电离方程式的书写.
专题:电离平衡与溶液的pH专题.
分析:先判断电解质的强弱,强电解质用“═”,电离方程式应遵循质量守恒定律和电荷守恒,并注意原子团不可拆分来解答.
解答: 解:A、CaCl2为强电解质,电离方程式为CaCl2=Ca2++2Cl﹣,遵循质量守恒定律和电荷守恒,故A正确;
B、Na2SO4为强电解质,电离方程式为Na2SO4=2Na++SO42﹣,遵循质量守恒定律和电荷守恒,故B正确;
C、HNO3为强电解质,电离方程式为HNO3=H++NO3﹣,遵循质量守恒定律和电荷守恒,故C正确;
D、KClO3为强电解质,电离方程式为KClO3=K++ClO3﹣,遵循质量守恒定律和电荷守恒,故D错误;
故选D.
点评:本题考查电离方程式的书写,明确电解质的强弱、物质中的原子团及电离方程式的书写方法即可解答,难度不大.


科目:高中化学 来源: 题型:
下列有关中和热的说法正确的是( )
A.中和热的热化学方程式:H+(l)+OH-(l)===H2O(l)ΔH=-57.3 kJ/mol
B.准确测量中和热的实验过程中,至少需测定温度4次
C.环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小
D.若稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和热数值更准确
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:① ;② (请填写两件主要的玻璃仪器)
(3)实验内容:
序号 实验方案 实验现象
① 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色
② 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色
(4)实验结论: .
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因. .
查看答案和解析>>
科目:高中化学 来源: 题型:
A.B C.D.E.F六种物质的转化关系如图所示(反应条件和部分产物未标出)
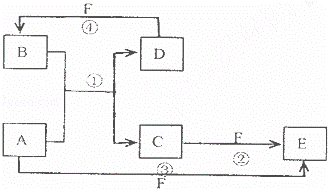
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A D反应都有红棕色气体生成,则A为 ,反应④的化学方程式为 .
(2)若A为常见的金属单质,D F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 .
(3)若A.D.F都是短周期非金属元素单质,且A.D所含元素同主族,A.F所含元素同周期,则反应①的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于1mol•1﹣1的Na2SO4溶液的叙述正确的是( )
A.溶液中含1molNa2SO4
B.Na+的浓度为1mol•1﹣1
C.配制时,将1molNa2SO4溶于1L水中
D.将322gNa2SO4•10H2O溶于少量水后再稀释成1000mL,即配制成相应溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500mL 0.1mol/L的NaOH溶液,有如下操作步骤:
①计算所需NaOH固体的质量并用托盘天平称取;
②将称量好的NaOH固体放入烧杯中,加入适量的蒸馏水溶解;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;
④继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;
⑤塞紧容量瓶的塞子,充分摇匀.
回答下列问题:
(1)本实验中除用到容量瓶和烧杯外,还需要用到的玻璃仪器有: .
(2)实验中用托盘天平实际称取NaOH固体的质量是 .
(3)上述实验操作步骤缺少一步,请补充所缺步骤的位置及内容: .
(4)在实验中,未进行操作④,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会偏高.称量时已观察到NaOH吸水,所配溶液的浓度会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
|
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3﹣+OH﹣=CaCO3↓+H2O |
|
| B. | 工业制漂白粉的反应:Cl2+Ca(OH)2=Ca2++Cl﹣+ClO﹣+H2O |
|
| C. | 用铜作电极电解饱和食盐水:2Cl﹣+2H2O=2OH﹣+Cl2↑+H2↑ |
|
| D. | 铜片跟稀硝酸反应:Cu+NO3﹣+4H+=Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0.下列研究目的和图示相符的是()
A B C D
研究
目的 温度(T)对反应的影响(T2>T1) 压强(p)对平衡常数的影响 温度(T)对反应的影响 压强(p)对反应的影响(p2>p1)
图示 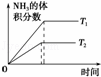
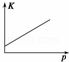
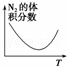
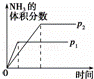
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com