
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0.下列研究目的和图示相符的是()
A B C D
研究
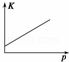
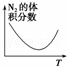
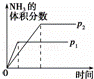
目的 温度(T)对反应的影响(T2>T1) 压强(p)对平衡常数的影响 温度(T)对反应的影响 压强(p)对反应的影响(p2>p1)
图示 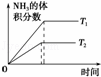
A. A B. B C. C D. D
考点: 体积百分含量随温度、压强变化曲线.
分析: A、依据先拐先平温度高分析,合成氨是放热反应,温度越高平衡逆向进行,氨气体积分数减小,温度越高速率越大,图象T2条件斜率应大;
B、平衡常数随温度变化;
C、图象分析可知是氮气体积分数减小后再增大,说明开始反应正向进行氮气体积分数最低时,反应达到平衡,后续升温是对化学平衡的影响,反应是放热反应,升温平衡逆向进行;
D、依据先拐先平压强大分析,反应是气体体积减小的反应,增大压强平衡正向进行,氨气体积分数增大,压强大反应速率大.先达到平衡.
解答: 解:A、依据先拐先平温度高分析,合成氨是放热反应,温度越高平衡逆向进行,氨气体积分数减小,温度越高速率越大,图象T2条件斜率应大,故A错误;
B、平衡常数随温度变化,不随压强变化,故B错误;
C、图象分析可知是氮气体积分数减小后再增大,说明开始反应正向进行氮气体积分数最低时,反应达到平衡,后续升温是对化学平衡的影响,反应是放热反应,升温平衡逆向进行,氮气体积分数增大,故C正确;
D、依据先拐先平压强大分析,反应是气体体积减小的反应,增大压强平衡正向进行,氨气体积分数增大,压强大反应速率大,先达到平衡,需要的时间短,故D错误;
故选C.
点评: 本题考查了化学平衡图象分析判断,化学平衡的建立和影响平衡的因素分析判断是解题关键,注意图象中表示的反应速率的改变,题目难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
下列电离方程式错误的是( )
A.CaCl2=Ca2++2Cl﹣ B.Na2SO4=2Na++SO42﹣
C.HNO3=H++NO3﹣ D.KClO3=K++Cl﹣+3O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液,其中有可能存在离子如下:Na+、Ba2+、Al3+、A1O2﹣、S2﹣、SO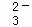 、SO
、SO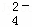 .现取该溶液进行有关实验,实验结果如图所示.
.现取该溶液进行有关实验,实验结果如图所示.

请回答下列问题:
(1)沉淀甲是
(2)沉淀乙是 由溶液甲生成沉淀乙的离子方程式为:
(3)沉淀丙是
(4)写出生成甲的离子方程式
(5)综合上述信息,可以肯定存在的离子 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,酸性由强到弱排列顺序错误的是( )
|
| A. | HClO4 H2SO4 H3PO4 | B. | HClO4 HClO3 HClO2 |
|
| C. | H2SO4 H2SO3 H2CO3 | D. | HClO HBrO4 HIO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为5L的密闭容器中,通入5mol N2和8mol H2,在一定条件下反应生成NH3,当反应进行到2min时,测得容器内有4mol NH3.则:
(1)2min时,容器内n(N2)= ,c(H2)= .
(2)2min内,以N2表示的平均反应速率v(N2)= .
(3)2min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H=a kJ•mol﹣1
其化学平衡常数K和温度T的关系如下表所示:则下列有关叙述正确的是()
T(℃) 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
A. a<0
B. 可测量容器总压变化来判定化学反应是否达到平衡
C. 温度为830℃时,若c(CO2)•c(H2)>c(CO)•c(H2O),此时v正>v逆
D. 温度不变,增大c(CO2),平衡右移,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
CO(g)+H2O(g)⇌H2(g)+CO2(g)△H<0,在其他条件不变的情况下()
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com