
【题目】下列物质不能通过化合反应直接得到的是( )
A. FeCl2 B. Fe(OH)3 C. CuS D. NaHCO3
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+ 物质的量浓度最大的是( )
A. 4 L 0.5 mol/L NaCl溶液 B. 5 L 0.4 mol/L NaOH溶液
C. 2 L 0.15 mol/L Na3PO4溶液 D. 1 L 0.3 mol/L Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中Fe3+还原成Fe2+ , 有利于人体吸收.
(1)在人体中进行Fe2+ ![]() Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂.
Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂.
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作剂.
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(HCl)的作用下转化成亚铁盐,此反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.第一电离能由大到小的顺序为N>O>C
B.由于C ![]() 和O
和O ![]() 为等电子体,所以可以判断O
为等电子体,所以可以判断O ![]() 的电子式为
的电子式为 ![]()
C.NO ![]() 中N采用sp2杂化,故NO
中N采用sp2杂化,故NO ![]() 的空间构型为三角锥形
的空间构型为三角锥形
D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1mol/LNa2SO4溶液中含氧原子的数目一定大于4NA
B. 1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C. 生成1mol氧化产物时转移电子数为4NA
D. 通常状况下11.2LCO2中含质子的数目为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四支试管中,过氧化氢分解产生氧气的化学反应速率最大的是( )
试管 | 温度 | 过氧化氢浓度 | 催化剂 |
A | 室温(25℃) | 12% | 有 |
B | 水浴加热(50℃) | 4% | 无 |
C | 水浴加热(50℃) | 12% | 有 |
D | 室温( 25℃) | 4% | 无 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学科学的说法,正确的是:
A.化学是在质子变化的层次上研究物质的一门基础学科
B.化学学科的特征是从宏观和微观两个角度认识物质
C.化学学科研究物质性质但不能创造出新物质
D.化学学科表征物质的方法与物理学科完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用氨化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
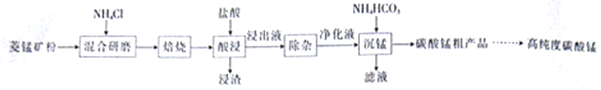
已知相关信息如下:
①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3.2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应:MnCO3+2NH4C1![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物 | Mn(OH)2 | MnCO3 | CaF2 | MgF2 |
Ksp | 2.0×10-13 | 2.0×10-11 | 2.0×10-10 | 7.0×10-11 |
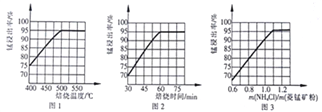
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、![]() 分别为_____、_____、_____、。
分别为_____、_____、_____、。
(2)“除杂“过程如下:
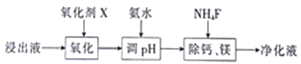
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O8>H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择_______(填字母)。
A. (NH4)2S2O8 B.MnO2 C.H2O2 D. Cl2
②调节pH时,pH可取的最低值为________。
③当CaF2、MgF2 两种沉淀共存时,若溶液中c(Ca2+) =1.0×10-5mol/L,则c(Mg2+) =_____mol/L。
(3)“沉锰”过程中,不用碳酸钠溶液替代NH4HCO3溶液,可能的原因是____________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL作锥形瓶中,加少量水湿润。再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为Mn(PO4)2]3-,多余的硝酸铵全部分解。用氨气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定,发生的反应为:
[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3+ +2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com