
【题目】2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(C1O2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaC1O2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:

已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
2.长期放置或高于60℃时NaC1O2易分解生成NaC1O3和NaCl
(1)步骤1中,生成C1O2的离子方程式是___,通人空气的作用是___。
(2)方法1中,反应的离子方程式是___,利用方法1制NaC1O2时,温度不能超过20℃,可能的原因是___。
(3)方法2中,NaC1O2在___生成(选填“阴极”或“阳极”)。
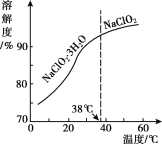
(4)NaC1O2的溶解度曲线如图所示,步骤3中从NaC1O2溶溶液中获得NaC1O2的操作是___。
(5)为测定制得的晶体中NaC1O2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmolL-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O32-=2I-+S4O62-)。样品中NaC1O2的质量分数为___。(用含a、b、c的代数式表小)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是___(用离子方程式和文字表示)。
(6)NaC1O2使用时,加入稀盐酸即可迅速得到C1O2。但若加入盐酸浓度过大,则气体产物中Cl2的含量会增大,原因是___。
【答案】2ClO3-+SO2=SO42-+2ClO2 稀释产生的ClO2,防止其分解爆炸 2OH-+2ClO2+H2O2=2ClO2-+O2+2H2O H2O2温度较高时易分解 阴极 加热温度至略低于60°C,浓缩,冷却至略高于38°C结晶,过滤,洗涤 ![]() 4H++4I-+O2=I2+2H2O,消耗Na2S2O3增多,结果偏高 亚氯酸钠与较浓盐酸混合,氧化性还原性增强,发生氧化还原反应,生成氯气
4H++4I-+O2=I2+2H2O,消耗Na2S2O3增多,结果偏高 亚氯酸钠与较浓盐酸混合,氧化性还原性增强,发生氧化还原反应,生成氯气
【解析】
(1)![]() (3)NaC1O3溶液与SO2发生氧化还原反应,生成ClO2,而由题给信息可知,纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下,故加入空气稀释;方法1:在碱性环境下,用H2O2还原C1O2得到NaC1O2;方法2:在阴极上ClO2被还原生成ClO2-,其电极方程式为:ClO2+e-=ClO2-;
(3)NaC1O3溶液与SO2发生氧化还原反应,生成ClO2,而由题给信息可知,纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下,故加入空气稀释;方法1:在碱性环境下,用H2O2还原C1O2得到NaC1O2;方法2:在阴极上ClO2被还原生成ClO2-,其电极方程式为:ClO2+e-=ClO2-;
(4)由溶解度曲线可知,温度低于38℃时,析出晶体NaClO23H2O,温度高于38℃时析出晶体NaClO2,据此分析解答;
(5)由ClO2-+4I-+4H+=2H2O+2I2+Cl-、I2+2S2O32-=2I-+S4O62-可得关系式NaClO2~2I2~4S2O32-,根据关系式NaClO2~2I2~4S2O32-进行计算;
(6)盐酸浓度较大,NaC1O2与浓HCl发生氧化还原反应生成氯气;
(1)步骤1,NaC1O3溶液与SO2发生氧化还原反应,生成ClO2,根据得失电子守恒,离子反应方程式为:2ClO3-+SO2=SO42-+2ClO2;由题给信息可知,纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下,则通人空气的作用是稀释产生的ClO2,防止其分解爆炸,故答案为:2ClO3-+SO2=SO42-+2ClO2;稀释产生的ClO2,防止其分解爆炸;
(2)方法1,在碱性环境下,用H2O2还原C1O2得到NaC1O2,根据得失电子守恒,反应的离子方程式未:2OH-+2ClO2+H2O2=2ClO2-+O2+2H2O;温度较高时H2O2易分解,所以温度不能超过20℃,故答案为:2OH-+2ClO2+H2O2=2ClO2-+O2+2H2O;H2O2温度较高时易分解;
(3)方法2,ClO2生成ClO2-,应被还原,在阴极生成,电极方程式为:ClO2+e-=ClO2-,所以在阴极上生成NaC1O2,故答案为:阴极;
(4)由NaC1O2的溶解度曲线可知,NaClO2饱和溶液中,温度低于38℃时,析出晶体是NaClO23H2O,温度高于38℃时析出晶体是
NaClO2,所以从NaC1O2溶溶液中获得NaC1O2的操作:加热温度至略低于60°C,浓缩,冷却至略高于38°C结晶,过滤,洗涤,故答案为:加热温度至略低于60°C,浓缩,冷却至略高于38°C结晶,过滤,洗涤;
(5)由ClO2-+4I-+4H+=2H2O+2I2+Cl-、I2+2S2O32-=2I-+S4O62-可得关系式为:NaClO2~2I2~4S2O32-,n(NaClO2)=![]() n(S2O32-)=
n(S2O32-)=![]() ,则样品中NaC1O2的质量分数为:
,则样品中NaC1O2的质量分数为: ;在滴定操作正确的情况下,测得结果偏高,可能为碘负离子被氧气氧化,生成更多的碘单质,消耗更多的Na2S2O3,结果偏高,故答案为:
;在滴定操作正确的情况下,测得结果偏高,可能为碘负离子被氧气氧化,生成更多的碘单质,消耗更多的Na2S2O3,结果偏高,故答案为:![]() ;4H++4I-+O2=I2+2H2O,消耗
;4H++4I-+O2=I2+2H2O,消耗
Na2S2O3增多,结果偏高;
(6)盐酸浓度大时,NaC1O2与浓HCl发生氧化还原反应生成氯气,故答案为:亚氯酸钠与较浓盐酸混合,氧化性还原性增强,发生氧化还原反应,生成氯气。


科目:高中化学 来源: 题型:
【题目】主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增加,且均不大于20。
的原子序数依次增加,且均不大于20。![]() 、
、![]() 、
、![]() 族序数之和为10;
族序数之和为10;![]() 的原子半径在同周期主族元素中最小;
的原子半径在同周期主族元素中最小;![]() 与
与![]() 形成的化合物常温下可与饱和
形成的化合物常温下可与饱和![]() 溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
A.简单离子半径:![]()
B.![]() 的单质是人类将太阳能转化为电能的常用材料
的单质是人类将太阳能转化为电能的常用材料
C.![]() 与
与![]() 形成的化合物均满足8电子稳定结构
形成的化合物均满足8电子稳定结构
D.![]() 与
与![]() 形成的化合物与饱和
形成的化合物与饱和![]() 溶液的反应可选用启普发生器
溶液的反应可选用启普发生器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是制造染料的重要原料,某同学在实验室里用如图所示装置制取硝基苯,主要步骤如下:

①在大试管里将2 mL浓硫酸和1.5 mL浓硝酸混合,摇匀,冷却到50~60 ℃以下;然后逐滴加入1 mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60 ℃的水浴中加热10分钟。
完成下列填空:
(1)指出上图中的错误:__________、____________。
(2)向混合酸中加入苯时,“逐滴加入”“边滴边振荡试管”的目的是__________________________。
(3)反应一段时间后,混合液明显分为两层,上层主要物质是________(填物质名称)。把反应后的混合液倒入盛有冷水的烧杯里,搅拌,可以看到________(填字母)。
a.水面上是含有杂质的硝基苯
b.水底有苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
(4)为了获得纯硝基苯,实验步骤:①水洗、分液;②将粗硝基苯转移到盛有__________的烧杯中洗涤、用__________(填仪器名称)进行分离;③__________;④干燥;⑤__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶2的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A.①②③ B.①②④ C.②③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示:
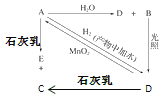
(1)请分别写出下列物质的化学式(如为溶液请填溶质的化学式):
A________、B________、D________。
(2)写出下列反应的化学方程式或离子方程式(请注明反应条件):
A+H2O(离子方程式):_____________;
A+石灰乳(化学方程式):______________;
E露置在空气中的第1个化学方程式:___________。
(3)漂白粉的有效成分是________(化学名称),保存漂白粉的方法__________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某化学小组探究硝酸银溶液的性质。
装置 | 实验序号 | 实验操作 | 实验现象 |
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
实验III | 1.向试管中滴加1mL0.1molL-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
(1)常温下,0.1mo1L-1AgNO3溶液pH约为4,请用离子方程式解释原因___。
(2)实验I中,反应的化学方程式是___。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的化学方程式是___。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___。
(4)实验中,产生黄色沉淀的离子方程式是___。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___,检验B烧杯中产物的操作及现象是___,该氧化还原反应的离子方程式是__。

(5)对比实验III和实验IV,实验III无I2生成的可能原因是___(写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达不正确的是
A. 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B. 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C. 某元素基态原子的电子排布图![]()
D. Ca2+离子基态电子排布式为1s22s22p63s23p6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com