
【题目】主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增加,且均不大于20。
的原子序数依次增加,且均不大于20。![]() 、
、![]() 、
、![]() 族序数之和为10;
族序数之和为10;![]() 的原子半径在同周期主族元素中最小;
的原子半径在同周期主族元素中最小;![]() 与
与![]() 形成的化合物常温下可与饱和
形成的化合物常温下可与饱和![]() 溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
A.简单离子半径:![]()
B.![]() 的单质是人类将太阳能转化为电能的常用材料
的单质是人类将太阳能转化为电能的常用材料
C.![]() 与
与![]() 形成的化合物均满足8电子稳定结构
形成的化合物均满足8电子稳定结构
D.![]() 与
与![]() 形成的化合物与饱和
形成的化合物与饱和![]() 溶液的反应可选用启普发生器
溶液的反应可选用启普发生器
【答案】D
【解析】
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20.W与Z形成的化合物常温下可与饱和NaCl溶液反应,产生的气体常用于切割和焊接金属,该气体为乙炔,则W为C元素,Z为Ca元素;W、X、Z族序数之和为10,则X的族序数=10-4-2=4,位于ⅣA族,则X为Si元素;Y的原子半径在同周期主族元素中最小,Y的原子序数大于Si,位于第三周期,为Cl元素,据此解答。
A.Y为Cl元素,Z为Ca元素,其离子核外电子排布相同,核电荷数越大,半径越小,则简单离子半径:![]() ,故A正确;
,故A正确;
B.X为Si元素,其单质是良好的半导体材料,可用于知道太阳能电池,是将太阳能转化为电能的常用材料,故B正确;
C.X为Si元素,Y为Cl元素,![]() 与
与![]() 形成的化合物为四氯化硅,电子式为
形成的化合物为四氯化硅,电子式为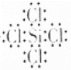 ,均满足8电子稳定结构,故C正确;
,均满足8电子稳定结构,故C正确;
D.![]() 与
与![]() 形成的化合物为碳化钙,与饱和
形成的化合物为碳化钙,与饱和![]() 溶液的反应生成乙炔和氢氧化钙,氢氧化钙微溶,可堵塞启普发生器,失去控制反应的作用,不能用启普发生器,一般使用广口瓶或圆底烧瓶进行该反应,故D错误;
溶液的反应生成乙炔和氢氧化钙,氢氧化钙微溶,可堵塞启普发生器,失去控制反应的作用,不能用启普发生器,一般使用广口瓶或圆底烧瓶进行该反应,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】实验室需要0.5 mol/L H2SO4溶液500 mL。根据溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号)。
(2)下列操作中,500ml容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取220 mL溶液
(3)实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液的浓度将____ 0.5mol/L(填“大于”“等于”或“小于”,下同)。若溶液未冷却即转移至容量瓶定容,则所配制溶液浓度将________0.5 mol/L。
(4)根据计算得知:所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
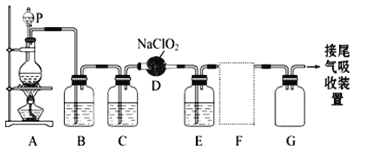
(1)仪器P的名称是_________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:______________________________。
(3)B装置中所盛试剂是____________________。
(4)F为ClO2收集装置,应选用的装置是___________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。
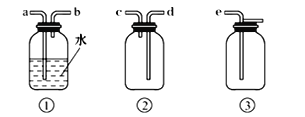
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
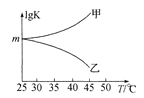
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。
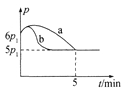
②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵受热分解的反应方程式为:![]() ,设
,设![]() 为阿伏加德罗常数的数值。下列说法正确的( )
为阿伏加德罗常数的数值。下列说法正确的( )
A.标准状况下,每生成![]() 气体转移电子数目为
气体转移电子数目为![]()
B.![]() 既是氧化剂又是还原剂,氧化产物只有
既是氧化剂又是还原剂,氧化产物只有![]()
C.![]() 的
的![]() 溶液中
溶液中![]() 的数目为
的数目为![]()
D.![]() 和
和![]() 混合充分反应后生成
混合充分反应后生成![]() 的分子数为
的分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分离、提纯的常用装置如图所示,根据题意选择合适的装置填入相应位置。

(1)我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写到:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”所用的是__装置(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)《本草衍义》中对精制砒霜过程的叙述为:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下重如乳,尖长者为胜,平短者次之。”文中涉及的操作方法所用是_____装置。
(3)海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
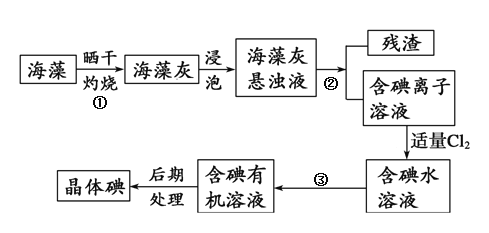
其中分离步骤①、②、③所用分别为:_____装置、_____装置、_____装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,使用
时,使用![]() 调节溶液
调节溶液![]() 过程中,二元弱酸
过程中,二元弱酸![]() 溶液中含
溶液中含![]() 微粒的分布分数如图所示。下列叙述中正确的是( )
微粒的分布分数如图所示。下列叙述中正确的是( )
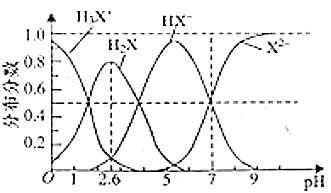
A.溶液![]() 由1升至2.6时主要存在的反应是
由1升至2.6时主要存在的反应是![]()
B.![]() 溶液中
溶液中![]()
C.![]()
D.溶液呈中性时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含![]() 族的磷、砷(
族的磷、砷(![]() )等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
)等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)下列状态的磷中,电离最外层一个电子所需能量最小的是__________(填标号)。
A.![]() B.
B. ![]() C.
C.![]() D.
D.![]()
(2)常温下![]() 是一种白色晶体,由
是一种白色晶体,由![]() 、
、![]() 两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知
两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知![]() 、
、![]() 两种微粒分别与
两种微粒分别与![]() 、
、![]() 互为等电子体,则
互为等电子体,则![]() 为________,其中心原子杂化轨道类型为________,
为________,其中心原子杂化轨道类型为________,![]() 为________。
为________。
(3)![]() 的
的![]() 、
、![]() 、
、![]() 分别为
分别为![]() 、
、![]() 、
、![]() ,根据结构与性质的关系解释
,根据结构与性质的关系解释![]() 远大于
远大于![]() 的原因______________。
的原因______________。
(4)![]() 的空间构型为_____________。
的空间构型为_____________。
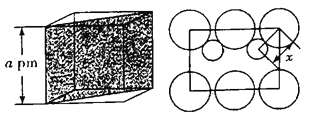
(5)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(![]() )照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图所示,晶胞参数
)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图所示,晶胞参数![]() 。
。
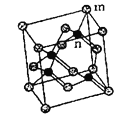
①砷化镓的化学式为__________,镓原子的配位数为__________。
②砷化镓的晶胞密度__________![]() (列式并计算,
(列式并计算,![]() ,精确到小数点后两位),如图是沿立方格子对角面取得的截图,
,精确到小数点后两位),如图是沿立方格子对角面取得的截图,![]() 位置
位置![]() 原子与
原子与![]() 位置
位置![]() 原子的核间距x=________
原子的核间距x=________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(C1O2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaC1O2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:

已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
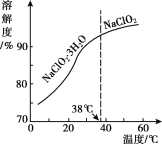
2.长期放置或高于60℃时NaC1O2易分解生成NaC1O3和NaCl
(1)步骤1中,生成C1O2的离子方程式是___,通人空气的作用是___。
(2)方法1中,反应的离子方程式是___,利用方法1制NaC1O2时,温度不能超过20℃,可能的原因是___。
(3)方法2中,NaC1O2在___生成(选填“阴极”或“阳极”)。
(4)NaC1O2的溶解度曲线如图所示,步骤3中从NaC1O2溶溶液中获得NaC1O2的操作是___。
(5)为测定制得的晶体中NaC1O2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmolL-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O32-=2I-+S4O62-)。样品中NaC1O2的质量分数为___。(用含a、b、c的代数式表小)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是___(用离子方程式和文字表示)。
(6)NaC1O2使用时,加入稀盐酸即可迅速得到C1O2。但若加入盐酸浓度过大,则气体产物中Cl2的含量会增大,原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com