
【题目】含![]() 族的磷、砷(
族的磷、砷(![]() )等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
)等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)下列状态的磷中,电离最外层一个电子所需能量最小的是__________(填标号)。
A.![]() B.
B. ![]() C.
C.![]() D.
D.![]()
(2)常温下![]() 是一种白色晶体,由
是一种白色晶体,由![]() 、
、![]() 两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知
两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知![]() 、
、![]() 两种微粒分别与
两种微粒分别与![]() 、
、![]() 互为等电子体,则
互为等电子体,则![]() 为________,其中心原子杂化轨道类型为________,
为________,其中心原子杂化轨道类型为________,![]() 为________。
为________。
(3)![]() 的
的![]() 、
、![]() 、
、![]() 分别为
分别为![]() 、
、![]() 、
、![]() ,根据结构与性质的关系解释
,根据结构与性质的关系解释![]() 远大于
远大于![]() 的原因______________。
的原因______________。
(4)![]() 的空间构型为_____________。
的空间构型为_____________。
(5)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(![]() )照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图所示,晶胞参数
)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图所示,晶胞参数![]() 。
。
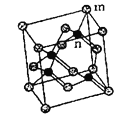
①砷化镓的化学式为__________,镓原子的配位数为__________。
②砷化镓的晶胞密度__________![]() (列式并计算,
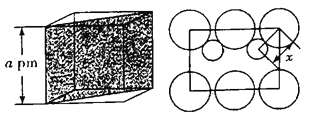
(列式并计算,![]() ,精确到小数点后两位),如图是沿立方格子对角面取得的截图,
,精确到小数点后两位),如图是沿立方格子对角面取得的截图,![]() 位置
位置![]() 原子与
原子与![]() 位置
位置![]() 原子的核间距x=________
原子的核间距x=________![]() 。
。
【答案】![]()
![]()
![]()
![]() 第一步电离出的氢离子抑制了第二步的电离 正四面体
第一步电离出的氢离子抑制了第二步的电离 正四面体 ![]() 4
4 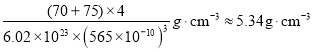
![]()
【解析】
(1)根据图示判断微粒的电离能状态,结合电离最外层的一个电子需要的能量:基态大于激发态,第一电离能小于第二电离能小于第三电离能小于第四电离能分析判断;
(2) PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-;
(3) 根据磷酸的电离平衡常数进行解答;
(4)根据中心原子价层电子互斥理论分析判断;
(5)①根据砷化镓晶胞的结构图,m位置Ga原子,n位置As原子,利用均摊法可知,晶胞中含有Ga原子数为8×![]() +6×
+6×![]() =4,含有As原子数为4,据此判断其化学式,根据晶胞图可知,镓原子周围距离最近的砷原子数为4,据此答题;
=4,含有As原子数为4,据此判断其化学式,根据晶胞图可知,镓原子周围距离最近的砷原子数为4,据此答题;
②晶胞的边长为565pm,所以晶胞的体积为(565pm)3,根据ρ=![]() 计算密度,晶胞的边长为565pm,所以晶胞的体对角线为
计算密度,晶胞的边长为565pm,所以晶胞的体对角线为![]() ×565pm,m位置Ga原子与n位置As原子之间的距离应为晶胞体对角线的
×565pm,m位置Ga原子与n位置As原子之间的距离应为晶胞体对角线的![]() ,据此计算。
,据此计算。
(1)A.![]() 为磷原子的基态原子核外电子排布图,失去最外层一个电子,为第一电离能;
为磷原子的基态原子核外电子排布图,失去最外层一个电子,为第一电离能;
B.![]() 为磷原子的基态原子失去两个电子的核外电子排布图,再失去最外层一个电子,为第三电离能;
为磷原子的基态原子失去两个电子的核外电子排布图,再失去最外层一个电子,为第三电离能;
C.![]() 为磷原子的基态原子失去一个电子的核外电子排布图,再失去最外层一个电子,为第二电离能;
为磷原子的基态原子失去一个电子的核外电子排布图,再失去最外层一个电子,为第二电离能;
D.![]() 为磷原子的基态原子失去三个电子的核外电子排布图,再失去最外层一个电子,为第四电离能;
为磷原子的基态原子失去三个电子的核外电子排布图,再失去最外层一个电子,为第四电离能;
结合电离最外层的一个电子需要的能量:基态大于激发态,第一电离能小于第二电离能小于第三电离能小于第四电离能,故电离最外层一个电子所需能量最小的是A,答案选A。
(2) PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6,即发生反应为:2PCl5=PCl4++PCl6,已知A.B两种微粒分别与CCl4、SF6互为等电子体,则A为:PCl4+,PCl4+中P没有孤电子对。含四个σ键,所以原子杂化方式是sp3,B为:PCl6;
(3)相同条件下K越大,酸的电离程度越大,所以相同条件下,电离平衡常数越小,表示弱电解质的电离能力越弱,多元弱酸分步电离,电离程度依次减小,从H3PO4的Kl、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13看出:磷酸第一步电离出氢离子后变为阴离子,生成的阴离子发生第二步电离时,第一步产生的氢离子对生成的阴离子的电离起抑制作用,使阴离子的第二步电离平衡逆向移动,导致难电离出带正电荷的氢离子,因此Kl远大于K2;
(4)![]() 的中心原子P的价层电子对数=4+
的中心原子P的价层电子对数=4+![]() =4,则P原子为sp3杂化,五个原子构成的微粒,空间构型为正四面体;
=4,则P原子为sp3杂化,五个原子构成的微粒,空间构型为正四面体;
(5)①根据砷化镓晶胞的结构图,m位置Ga原子,n位置As原子,利用均摊法可知,晶胞中含有Ga原子数为8×![]() +6×
+6×![]() =4,含有As原子数为4,其化学式为GaAs,根据晶胞图可知,镓原子周围距离最近的砷原子数为4,所以镓原子的配位数为4;
=4,含有As原子数为4,其化学式为GaAs,根据晶胞图可知,镓原子周围距离最近的砷原子数为4,所以镓原子的配位数为4;
②晶胞的边长为565pm,所以晶胞的体积为(565pm)3,所以晶体的密度为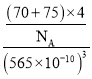 g/cm3=5.34g/cm3,晶胞的边长为565pm,所以晶胞的体对角线为
g/cm3=5.34g/cm3,晶胞的边长为565pm,所以晶胞的体对角线为![]() ×565pm,m位置Ga原子与n位置As原子之间的距离应为晶胞体对角线的
×565pm,m位置Ga原子与n位置As原子之间的距离应为晶胞体对角线的![]() ,所以Ga原子与As原子之间的距离为
,所以Ga原子与As原子之间的距离为![]() pm。
pm。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增加,且均不大于20。
的原子序数依次增加,且均不大于20。![]() 、
、![]() 、
、![]() 族序数之和为10;
族序数之和为10;![]() 的原子半径在同周期主族元素中最小;
的原子半径在同周期主族元素中最小;![]() 与
与![]() 形成的化合物常温下可与饱和
形成的化合物常温下可与饱和![]() 溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
A.简单离子半径:![]()
B.![]() 的单质是人类将太阳能转化为电能的常用材料
的单质是人类将太阳能转化为电能的常用材料
C.![]() 与
与![]() 形成的化合物均满足8电子稳定结构
形成的化合物均满足8电子稳定结构
D.![]() 与
与![]() 形成的化合物与饱和
形成的化合物与饱和![]() 溶液的反应可选用启普发生器
溶液的反应可选用启普发生器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
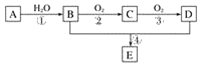
图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。
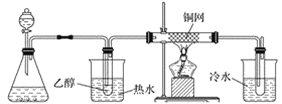
甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他们对钠在CO2气体中燃烧进行了下列实验:
(1)若用下图装置制备CO2,则发生装置中反应的离子方程式为_________。
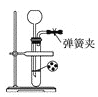
(2)将制得的CO2净化、干燥后由a口缓缓通入下图装置,待装置中的空气排净后点燃酒精灯,观察到玻璃直管中的钠燃烧,火焰为黄色。待冷却后,管壁附有黑色颗粒和白色物质。
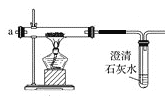
①能说明装置中空气已经排净的现象是_________。
②若未排尽空气就开始加热,则可能发生的化学反应方程式主要为_________。
(3)若钠着火,可以选用的灭火物质是_________。
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(4)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是_________。
(5)为确定该白色物质的成分,该小组进行了如下实验:
实验步骤 | 实验现象 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaCl2溶液 | 出现白色沉淀 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
①通过对上述实验的分析,你认为上述三个假设中,___成立(填序号)。
②由实验得出:钠在CO2中燃烧的化学方程式为_____;每生成1mol氧化产物,转移的电子数为____。
(6)在实验(2)中还可能产生另一种尾气,该气体为________;处理该尾气的方法为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“实验结论”与“实验操作及现象”相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液变为红色 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是制造染料的重要原料,某同学在实验室里用如图所示装置制取硝基苯,主要步骤如下:

①在大试管里将2 mL浓硫酸和1.5 mL浓硝酸混合,摇匀,冷却到50~60 ℃以下;然后逐滴加入1 mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60 ℃的水浴中加热10分钟。
完成下列填空:
(1)指出上图中的错误:__________、____________。
(2)向混合酸中加入苯时,“逐滴加入”“边滴边振荡试管”的目的是__________________________。
(3)反应一段时间后,混合液明显分为两层,上层主要物质是________(填物质名称)。把反应后的混合液倒入盛有冷水的烧杯里,搅拌,可以看到________(填字母)。
a.水面上是含有杂质的硝基苯
b.水底有苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
(4)为了获得纯硝基苯,实验步骤:①水洗、分液;②将粗硝基苯转移到盛有__________的烧杯中洗涤、用__________(填仪器名称)进行分离;③__________;④干燥;⑤__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶2的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A.①②③ B.①②④ C.②③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com