

图3-12
试完成下列问题:
(1)写出A、B、C、D、E、F的化学式。A:_________、B:_________ 、C:_________、D:___________、E:___________、F:___________。
(2)写出D、E反应的化学方程式:_________________________________。
(3)从D开始,按其中一种元素价态升高体系,用框图表示出其单质或化合物的转化过程:
![]() _____________________________________________________________。
_____________________________________________________________。
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
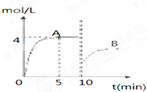 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.| 16 |
| (a-2)×(b-4)3 |
| 16 |
| (a-2)×(b-4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
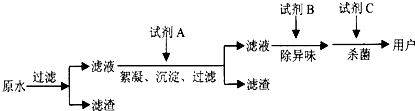
查看答案和解析>>
科目:高中化学 来源: 题型:
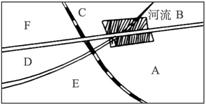
图5-12
(1)若该厂以含硫质量分数为2%的重油为燃料,假设1 dm3重油(密度为0.95 g·cm-3)燃烧生成14 m3标准状况下的烟道气,计算烟道气中SO2的体积分数。
(2)请在图5-12中A、B、C、D、E、F处选一最佳建厂处,说明理由。
(3)请你预测此工厂将有哪些方面对环境造成污染?
(4)请你用物理、化学、生物等方面的知识设计一个保护环境、控制污染的方案。
(5)以含硫3.5%的重油为燃料,重油使用量为0.18 dm3(kW·h)-1,该厂开工率为(每年实际运转天数)为80%,对烟道气的脱硫回收的SO2能生产多少千克(NH4)2SO4或生产石膏(CaSO4·2H2O)多少千克?若将这些SO2制成70%的浓硫酸,可生产这种浓硫酸多少千克?
查看答案和解析>>
科目:高中化学 来源: 题型:
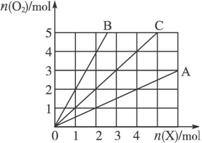
图3-12
A.2∶1 B.1∶2 C.1∶1 D.任意比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com