
【题目】FeCl3在现代工业生产中应用广泛。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,
请回答下列问题:
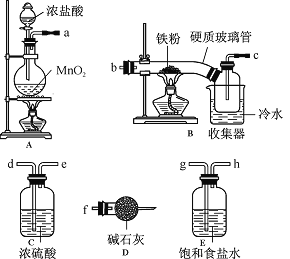
(1)装置的连接顺序为 (用a、b、c…h表示)。
(2)i.E中饱和食盐水的作用是 。
ii.D中碱石灰的作用是 。
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得FeCl3进入收集器,需进行的操作是 。
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
![]()
①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是 (用离子方程式表示)。
(5)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明 ;
实验②的目的是 ;
得出结论: 。
【答案】(1)aghdebcf;
(2)i.除去氯气中的氯化氢气体,防止生成FeCl2杂质;防止H2和Cl2混合爆炸;
ii.吸收没有反应完的氯气,以防污染空气;吸收空气中的水蒸气,防止生成的FeCl3潮解
(3)在沉积的FeCl3固体下方加热;
(4)①Fe3++3SCN-![]() Fe(SCN)3;②2Fe2+ + 2H+ + H2O2 =2Fe3+ + 2H2O
Fe(SCN)3;②2Fe2+ + 2H+ + H2O2 =2Fe3+ + 2H2O
(5)实验①说明SCN-发生了反应而不是Fe3+发生反应;实验②的目的是排除H2O2分解产生的O2氧化SCN-的可能;结论:H2O2将SCN-氧化成SO42—
【解析】
试题分析:(1)浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→d→e→b→c→f,故答案为:a、g、h、d、e、b、c、f;
(2)i饱和食盐水吸收氯化氢而抑制氯气溶解,防止生成FeCl2杂质;同时可以防止H2和Cl2混合爆炸;故答案为:除去氯气中的氯化氢气体,防止生成FeCl2杂质;防止H2和Cl2混合爆炸;
ii. D中碱石灰可以吸收没有反应完的氯气,以防污染空气;吸收空气中的水蒸气,防止生成的FeCl3潮解,故答案为:吸收没有反应完的氯气,以防污染空气;吸收空气中的水蒸气,防止生成的FeCl3潮解;
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。加热易升华,要使沉积得FeCl3进入收集器,在沉积的FeCl3固体下方加热,故答案为:在沉积的FeCl3固体下方加热;
(4)①Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,反应方程式为Fe3++3SCN-![]() Fe(SCN)3;②Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,离子方程式为2Fe2+ + 2H+ + H2O2 =2Fe3+ + 2H2O,故答案为:2Fe2+ + 2H+ + H2O2 =2Fe3+ + 2H2O;
Fe(SCN)3;②Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,离子方程式为2Fe2+ + 2H+ + H2O2 =2Fe3+ + 2H2O,故答案为:2Fe2+ + 2H+ + H2O2 =2Fe3+ + 2H2O;
(5)根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀HCl和BaCl2溶液,产生白色沉淀,说明生成了硫酸根;根据②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,所以氧化SCN-的为双氧水;故答案为:实验①说明SCN-发生了反应而不是Fe3+发生反应;实验②的目的是排除H2O2分解产生的O2氧化SCN-的可能;结论:H2O2将SCN-氧化成SO42—。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.胶体的丁达尔效应与微粒直径大小有关
B.氨气的水溶液能导电,因此是NH3电解质
C.电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关
D.向饱和氯化钠溶液中加入一小块钠,溶液中有固体析岀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验需要0.80 mol·L-1 NaOH溶液475 mL和0.40 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
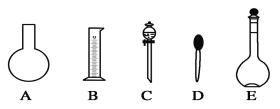
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列操作中,不能用容量瓶实现的有______________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为_______g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______(填”大于”、“等于”或“小于”,下同)0.8 mol·L-1。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______0.8 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,选用________mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一些茶叶的包装盒中有一个小袋,将小袋打开可看到灰黑色粉末,其中有的已变成棕褐色。将这种灰黑色粉末投入稀盐酸后,取其上层清液并加几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是 ( )
A.该灰黑色粉末作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有关物质的叙述正确的是( )
①酸性氧化物肯定是非金属氧化物 ②不能跟酸反应的氧化物一定能跟碱反应 ③碱性氧化物肯定是金属氧化物 ④分散系一定是混合物 ⑤浊液均可用过滤的方法分离
A.①③ B.③④ C.②④ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用量筒量取液体时,将量筒平放,仰视液体凹液面最低处读数为16.0 mL,倾倒出一部分溶液,又俯视液体凹液面最低处,读数为10.0 mL,该同学取出液体的体积是()
A. 大于6.0 mL B. 等于6.0 mL
C. 小于6.0 mL D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,可缓缓分解;
②能溶于水;
③遇酸及酸性药物则产生二氧化碳;
④胃酸患者过多服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸作用是中和反应,作用缓慢而持久,可维持3~4小时。
②凝胶本身覆盖于溃疡面上,具有保护作用。
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是________(填化学式);乙中含有的主要化学成分是________(填化学式)。
(2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式:____________________________。
(3)试写出乙中含有的主要化学成分溶于NaOH溶液的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.卤化氢中,以HF沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.N2分子中有一个σ键,2个π键
D.在元素周期表中,s区,d区和ds区的元素都是金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com