
分析 根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$计算甲烷、HCl、硫化氢的物质的量,同温同压下,体积之比等于物质的量之比;同温同压下,密度之比等于相对分子质量之比;根据m=nM计算各物质的质量,再进行排序;结合分子式计算氢原子的物质的量,氢原子物质的量越大,氢原子数目越大.
解答 解:①6.72LCH4的物质的量为0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6g硫化氢的物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,④0.2mol氨气(NH3).
同温同压下,体积之比等于物质的量之比,所以体积②>③>①>④;
①CH4相对分子质量为16,②HCl相对分子质量为36.5③硫化氢相对分子质量为34,④氨气相对分子质量为17,同温同压下,密度之比等于相对分子质量之比,所以密度②>③>④>①;
①6.72LCH4的质量为0.3mol×16g/mol=4.8g,②3.01×1023个HCl分子的质量为0.5mol×36.5g/mol=18.25g,③13.6g硫化氢,④0.2mol氨气(NH3)的质量为0.2mol×17g/mol=3.4g,所以质量②>③>①>④;
氢原子物质的量分别为:①0.3mol×4=1.2mol,②0.5mol,③0.4mol×2=0.8mol,④0.2mol×3=0.6mol,所以氢原子数①>③>④>②,
故答案为:②>③>①>④;②>③>④>①;②>③>①>④;①>③>④>②.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及推论,注意对公式的理解与灵活应用,难度不大,旨在考查学生对基础知识的掌握.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
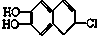 分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )| A. | 2mol、4mol、2mol | B. | 2mol、3mol、3mol | C. | 3mol、2mol、2mol | D. | 3mol、4mol、3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入品红溶液,品红褪色,加热后褪色,一定有SO32- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径∕10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.24 |
| 最高价或最低价 | -2 | +2 | +1 | +5 -3 | +7 -1 | +1 | +5 -3 | +3 |
| A. | 元素④⑤形成的化合物是离子化合物 | |
| B. | 元素⑦位于第二周期第V族 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物的碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
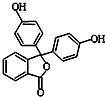 酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 核磁共振氢谱中有7个峰 | |
| C. | 能发生加聚反应生成高分子化合物 | |
| D. | 1 mol该物质最多能与含4molNaOH的烧碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 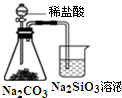 图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 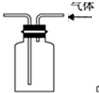 用图所示实验装置排空气法收集CO2气体 | |
| C. | 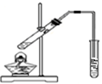 用图装置制备少量乙酸乙酯 | |
| D. | 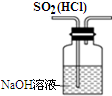 图装置可以用来除去SO2中的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c | B. | a=b=c | C. | c>a>b | D. | b>c>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com