
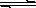 Cu2����aq����2OH����aq������������Ksp��2��10��20��
Cu2����aq����2OH����aq������������Ksp��2��10��20��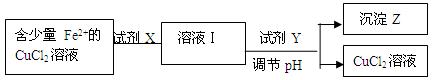
| ���� ���� | pH | |
| ��ʼ���� | ��ȫ���� | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
 A.H2O2 B.KMnO4 C.HNO3 D.Cl2
A.H2O2 B.KMnO4 C.HNO3 D.Cl2 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
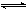 Ca2++2OH��
Ca2++2OH��| A����Һ��Ca2+��Ŀ���� | B����Һ��Ca2+��Ŀ���� |
| C��c(Ca2+)���� | D��c(Ca2+)���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a=b | B��c(H+)=c(OH��)=10-7mol��L��1 |
| C�����Һ��Kw=c2��OH���� | D��c(H+)+c(B+)=c(OH��)+c(A��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
A��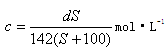 | B��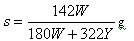 |
| C��100X=YS | D��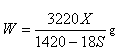 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ˮ�� | B��ʳ��ˮ | C������ | D��С�մ�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ
Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ  ��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�����
��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ����� ����2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��
����2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��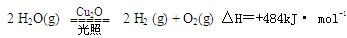 2 H2O(g)
2 H2O(g) | ʱ��/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
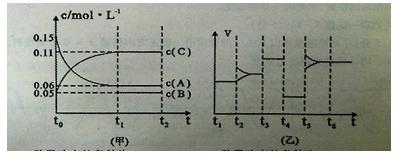
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��9.0 | B��9.5 | C��8.5 | D��10.5 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com