
��ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��
SiCl4(g)��2H2(g)���������գ�
1����һ���¶��½���������Ӧ������Ӧ�������ݻ�Ϊ2 L��H2��ƽ����Ӧ����Ϊ0.1 mol/(L��min)��3 min��ﵽƽ�⣬��ʱ��ù��������________g��
2���÷�Ӧ��ƽ�ⳣ������ʽK��________������ͨ��________ʹK����
3��һ�������£����ܱպ��������У��ܱ�ʾ������Ӧһ���ﵽ��ѧƽ��״̬����________��
a��2v��(SiCl4)��v��(H2)
b���Ͽ�4 mol��Si��Cl����ͬʱ������4 mol��H��Cl��
c����������ܶȱ��ֲ���
d��c(SiCl4)��c(H2)��c(HCl)��1��2��4
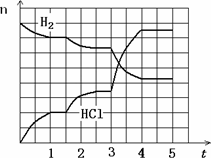
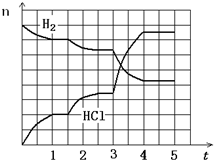
4������Ӧ��������ͼ��ʾ���������ʾ�������Ȼ�������ʵ���(mol)���������ʾʱ��(min)����������Ӧ����û�м������ȡ�����ʣ����1.5���Ӹı��������________����3���Ӹı��������________����ƽ��̬������ת������С��ʱ�����________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?�Ӷ���һģ����ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��
��2013?�Ӷ���һģ����ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��| ���� |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�������ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H������ѧ��Ӧ�ġ�H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ�ο����±���ļ������ݣ��ش��������⣺
���ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�������ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H������ѧ��Ӧ�ġ�H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ�ο����±���ļ������ݣ��ش��������⣺| ��ѧ�� | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| ����/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |

| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ��Դһ��2010�����9���¿���ѧ���� ���ͣ�013
|
ͨ���Ѳ�1 molij��ѧ�������յ��������ɸû�ѧ���ļ��ܣ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�������ڹ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)�������о���һЩ��ѧ���ļ������ݣ��������ã�
��ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��SiCl4(g)��2H2(g) | |
| [����] | |
A�� |
��412 kJ/mol |
B�� |
��412 kJ/mol |
C�� |
��236 kJ/mol |
D�� |
��236 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ��л�����������ѧ����ĩ��ѧ�������л�ѧ�Ծ��������棩 ���ͣ������
��ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��SiCl4(g)+
2H2(g)  Si
(s) + 4HCl(g) ��236kJ
Si
(s) + 4HCl(g) ��236kJ
���������գ�
��1����һ���¶��½���������Ӧ������Ӧ�������ݻ�Ϊ2L��H2��ƽ����Ӧ����Ϊ0.1mol/(L��min)��3min��ﵽƽ�⣬��ʱ��ù�������� g��
��2���÷�Ӧ��ƽ�ⳣ������ʽK�� ������ͨ��_______ʹK����
��3��һ�������£����ܱպ��������У��ܱ�ʾ������Ӧһ���ﵽ��ѧƽ��״̬���� ��
a��2v��(SiCl4)��v��(H2)
b���Ͽ�4molSi��Cl����ͬʱ������4molH��Cl��
c����������ܶȱ��ֲ���
d��c(SiCl4)��c(H2)��c(HCl)��1:2:4
��4������Ӧ������ͼ��ʾ���������ʾ�������Ȼ�������ʵ�����mol�����������ʾʱ�䣨min������������Ӧ����û�м������ȡ�����ʣ����1.5���Ӹı��������______����3���Ӹı��������__________����ƽ��̬������ת������С��ʱ�����_____________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com