
工业上高纯硅可以通过下列反应制取:SiCl4(g)+
2H2(g)  Si
(s) + 4HCl(g) -236kJ
Si
(s) + 4HCl(g) -236kJ
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为0.1mol/(L·min),3min后达到平衡,此时获得固体的质量 g。
(2)该反应的平衡常数表达式K= 。可以通过_______使K增大。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是 。
a.2v逆(SiCl4)=v正(H2)
b.断开4molSi-Cl键的同时,生成4molH-Cl键
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
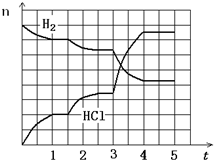
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是______,第3分钟改变的条件是__________,各平衡态中氢气转化率最小的时间段是_____________ 。
(本题共8分,33题2分,其余1分)
(1)8.4
(2)K=c(HCl)4/c(SiCl4)·c(H2)2,升温。
(3)ac
(4)减压,升温(且加催化剂),1—1.5分钟
【解析】
试题分析:(1)m(Si)=1/2n(H2)M(Si)=1/2×0.1mol/(L·min)×2L×3miin×28g/mol=8.4g
(2)Si为固体,所以K=c(HCl)4/c(SiCl4)·c(H2)2,因为正反应为吸热反应,升温平衡向右移动,K增大。
(3)a、正、逆速率相等,正确;b、断开4molSi-Cl键说明反应了1molSiCl4,生成4molH-Cl键说明生成4molHCl,都是正反应反应方向,不能说明达到平衡状态;c、混合气体密度保持不变,说明气体质量不变,达到平衡状态,正确;d、各物质的浓度之比与是否平衡无关,错误。
(4)1.5分钟H2物质的量逐渐减小,HCl物质的量逐渐增大,曲线斜率减小,说明平衡向正反应方向移动,化学反应速率变小,所以改变的条件是减小压强;第3分钟平衡向正反应方向移动,化学反应速率变大,改变的条件是升温(且加催化剂);因为两次平衡都是向右移动,所以氢气转化率最小的时间段为第一次平衡时间段:1—1.5分钟。
考点:本题考查化学反应速率的计算、化学平衡常数、化学平衡状态的判断、图像分析。


科目:高中化学 来源: 题型:
 (2013?河东区一模)工业上高纯硅可以通过下列反应制取:
(2013?河东区一模)工业上高纯硅可以通过下列反应制取:| 高温 |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |

| 高温 |
查看答案和解析>>
科目:高中化学 来源:河南省济源一中2010届高三9月月考化学试题 题型:013
|
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(ΔH).下面列举了一些化学键的键能数据,供计算用:
工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g) | |
| [ ] | |
A. |
+412 kJ/mol |
B. |
-412 kJ/mol |
C. |
+236 kJ/mol |
D. |
-236 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:上海市黄浦区2013年高考一模化学试题 题型:022
工业上高纯硅可以通过下列反应制取:
SiCl4(g)+2H2(g)完成下列填空:
1.在一定温度下进行上述反应,若反应容器的容积为2 L,H2的平均反应速率为0.1 mol/(L·min),3 min后达到平衡,此时获得固体的质量________g.
2.该反应的平衡常数表达式K=________.可以通过________使K增大.
3.一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是________.
a.2v逆(SiCl4)=v正(H2)
b.断开4 mol Si-Cl键的同时,生成4 mol H-Cl键
c.混合气体密度保持不变
d.c(SiCl4)∶c(H2)∶c(HCl)=1∶2∶4
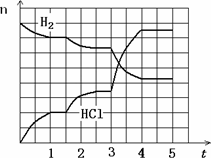
4.若反应过程如下图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是________,第3分钟改变的条件是________,各平衡态中氢气转化率最小的时间段是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com