
【题目】已知在溶液中 。室温下,在实验室里用0.01 mol·L-1的氢氧化钠溶液滴定20 mL的0.01 mol·L-1HX溶液,滴定曲线如图所示。下列叙述正确的是( )
。室温下,在实验室里用0.01 mol·L-1的氢氧化钠溶液滴定20 mL的0.01 mol·L-1HX溶液,滴定曲线如图所示。下列叙述正确的是( )
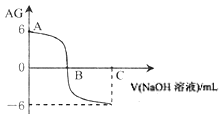
A. B点时c(X-) >c(Na+)
B. 室温时0.01 mol·L-1的HX溶液pH=6
C. A点时溶液中水的电离程度大于纯水的电离程度
D. 若C点时加入NaOH溶液40 mL,所得溶液中:c(X-)+2 c(HX) = c(OH-) - c(H+)
【答案】D
【解析】A. B点时,AG=0,即 =0,则c(H+)= c(OH-) ,溶液呈中性,根据溶液中电荷守恒式c(H+) +c(Na+)=c(X-)+c(OH-)可知,c(X-) =c(Na+),故A错误;B. 根据图象可知,0.01 mol/LHX溶液的AG=6,即
=0,则c(H+)= c(OH-) ,溶液呈中性,根据溶液中电荷守恒式c(H+) +c(Na+)=c(X-)+c(OH-)可知,c(X-) =c(Na+),故A错误;B. 根据图象可知,0.01 mol/LHX溶液的AG=6,即 =6,常温下水的离子积常数Kw=c(H+)×c(OH-)=10-14,解得c(H+)=10-4mol/L,溶液的pH=4,故B错误;C. HX是弱酸,酸抑制水的电离,所以A点时溶液中水的电离程度小于纯水的电离程度,故C错误;D. 若C点时加入NaOH溶液40 mL,充分反应后得到等浓度的NaX和NaOH的混合溶液,根据溶液中电荷守恒和物料守恒列式得:①c(H+) +c(Na+)=c(X-)+c(OH-),②2c(X-)+2 c(HX)=c(Na+),联立得:c(X-)+2 c(HX)+c(H+)=c(OH-),即c(X-)+2 c(HX) = c(OH-)-c(H+),故D正确;答案选D。
=6,常温下水的离子积常数Kw=c(H+)×c(OH-)=10-14,解得c(H+)=10-4mol/L,溶液的pH=4,故B错误;C. HX是弱酸,酸抑制水的电离,所以A点时溶液中水的电离程度小于纯水的电离程度,故C错误;D. 若C点时加入NaOH溶液40 mL,充分反应后得到等浓度的NaX和NaOH的混合溶液,根据溶液中电荷守恒和物料守恒列式得:①c(H+) +c(Na+)=c(X-)+c(OH-),②2c(X-)+2 c(HX)=c(Na+),联立得:c(X-)+2 c(HX)+c(H+)=c(OH-),即c(X-)+2 c(HX) = c(OH-)-c(H+),故D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、T是原子序数依次增大的五种短周期元素,且X、Y、Z、W的原子序数之和为32。其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻, Z、W位于同一主族。T的单质常用于自来水的杀菌消毒。
请回答下列问题:
(1) 写出W元素在周期表中的位置为________________。
(2) 由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的浓溶液只有在加热条件下能与金属铜反应,该反应的化学方程式为__________________。
(3) Y元素的气态氢化物与其最高价氧化物的水化物可以相互反应,写出其离子方程式:___________________。
(4) Y和T两元素的非金属性强弱为Y_________T (填“>” “<”或者“=”)。可以验证该结论的方法是____________。
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(5) 某化学兴趣小组欲通过实验探究元素N、C、Si非金属性强弱。实验装置如图:

①溶液a为_____________溶液、溶液b为___________溶液(均写化学式)。
②溶液C中反应的离子方程式为_____________________。
③经验证,N、C、Si的非金属性由强到弱为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
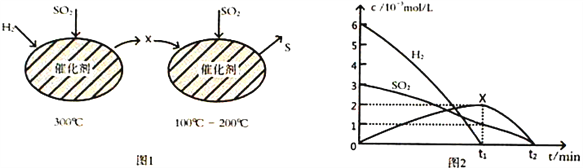
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
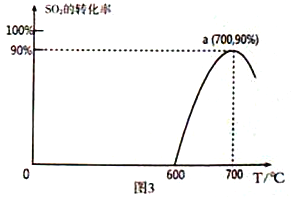
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 电解饱和食盐水,产生黄绿色气体:2NaCl + 2H2O![]() 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
B. 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32- + Ca2+ ==== CaCO3↓
C. 浓氨水检验泄露的氯气,产生白烟:2NH3 + 3Cl2 === 6HCl + N2
D. 铜丝溶于浓硝酸生成绿色溶液:3Cu + 8H+ + 2NO3- ![]() 3Cu2+ + 2NO↑+ 4H2O
3Cu2+ + 2NO↑+ 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是

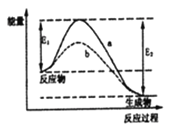
A. 使用催化剂,合成氨反应放出的热量减少
B. 在该过程中,N2、H2断键形成N原子和H原子
C. 在该过程中,N原子和H原子形成了含有非极性键的NH3
D. 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,甲容器中HCl气体和乙容器中的NH3气体所含的原子个数相等,则甲、乙两容器的体积之比为( )
A.2:1
B.1:2
C.1:1
D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,乙醛可发生分解:CH3CHO(l)![]() CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
反应Ⅰ:CH3CHO+ I2![]() CH3I2+HI+CO (慢)
CH3I2+HI+CO (慢)
反应Ⅱ:CH3I+HI![]() CH4+ I2
CH4+ I2
下列有关该反应的叙述中正确的是( )
A.反应速率与I2的浓度有关
B.HI在反应Ⅰ中是氧化产物
C.反应焓变的绝对值等于190kJ.mol-1
D.乙醛的反应速率主要取决于反应Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物(![]() )的说法正确的是
)的说法正确的是
A. 该物质所有碳原子一定在同一平面
B. 在一定条件下能发生加成反应、氧化反应、取代反应、还原反应、加聚反应
C. 与该物质具有相同官能团的芳香烃的同分异构体有2种
D. 1mol该物质最多可与4molH2或1molBr2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O
B.氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH﹣→CH2ClCOO﹣+H2O
C.用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH﹣ ![]() CH3COO﹣+NH4++3NH3+2Ag↓+H2O
CH3COO﹣+NH4++3NH3+2Ag↓+H2O
D.苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O→2C6H5OH+CO ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com