
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
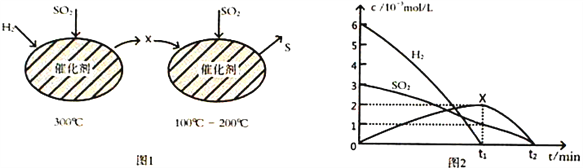
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
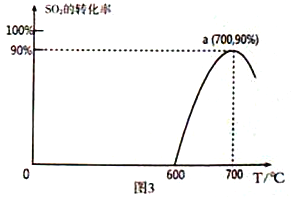
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
【答案】 CH4 (g)+2SO2 (g)=== CO2 (g)+2S (s)+2H2O(l) △H=-295.9 kJ/mol H2S 300℃ 2×10-3/t1 mol/(L· min) 2H2+SO2 ![]() S+2H2O < 36.45 mol/L SO32- +SO2 + H2O === 2HSO3- c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
S+2H2O < 36.45 mol/L SO32- +SO2 + H2O === 2HSO3- c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
【解析】(1)已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,则有
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) △H=-890.3 kJ/mol
②S(s)+O2(g)===SO2(g) △H=-297.2 kJ/mol
根据盖斯定律可知①-②×2即得到CH4和SO2反应的热化学方程式为CH4(g)+2SO2(g)===CO2(g)+2S(s)+2H2O(l) △H=-295.9 kJ/mol。
(2)①氢气与二氧化硫反应生成X,X与SO2反应生成S,反应中X是还原剂,则X为H2S。0~t1时间段内主要是生成X,则反应的温度为300℃,0~t1时间段二氧化硫浓度减少0.002mol/L,则用SO2表示的化学反应速率为0.002mol/L÷t1min=2×10-3/t1mol/(L·min)。②根据原子守恒可知反应中还有水生成,则总反应的化学方程式为2H2+SO2![]() S+2H2O。(3)①达到平衡后,升高温度二氧化硫的转化率降低,说明平衡向逆反应方向进行,该反应的ΔH<0。②a点SO2的转化率是0.9,消耗二氧化硫是0.9mol/L,生成CO2是0.9mol/L,S2(g)是0.45mol/L,剩余SO2是0.1mol/L,因此该温度下的平衡常数为
S+2H2O。(3)①达到平衡后,升高温度二氧化硫的转化率降低,说明平衡向逆反应方向进行,该反应的ΔH<0。②a点SO2的转化率是0.9,消耗二氧化硫是0.9mol/L,生成CO2是0.9mol/L,S2(g)是0.45mol/L,剩余SO2是0.1mol/L,因此该温度下的平衡常数为![]() =36.45。(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为SO32-+SO2+H2O===2HSO3-;25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶质是亚硫酸钠和亚硫酸氢钠的混合溶液,根据亚硫酸的第二步电离常数可知
=36.45。(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为SO32-+SO2+H2O===2HSO3-;25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶质是亚硫酸钠和亚硫酸氢钠的混合溶液,根据亚硫酸的第二步电离常数可知![]() ,因此溶液中各离子浓度的大小关系为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。
,因此溶液中各离子浓度的大小关系为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】生活中经常用到物质分离提纯的方法,以下说法错误的是( )
A.海水淡化是利用蒸馏的原理
B.用过滤的原理使用纱布将豆腐花和豆浆分离
C.酿酒时用萃取的原理将酒精的纯度提高
D.海水晒盐使用了蒸发的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示装置在实验室制备乙酸乙酯。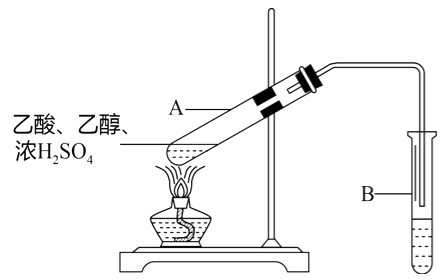
(1)A中发生反应的化学方程式是。
(2)B中盛放的试剂是。
(3)反应结束后,取下试管B振荡,静置。该过程中的现象是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期元素Q的原子最外层只有一个电子,下列说法正确的是( )
A. Q一定能与卤素形成共价键 B. Q一定能与卤素形成离子键
C. Q的单质中不存在化学键 D. Q与氧元素形成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在溶液中 。室温下,在实验室里用0.01 mol·L-1的氢氧化钠溶液滴定20 mL的0.01 mol·L-1HX溶液,滴定曲线如图所示。下列叙述正确的是( )
。室温下,在实验室里用0.01 mol·L-1的氢氧化钠溶液滴定20 mL的0.01 mol·L-1HX溶液,滴定曲线如图所示。下列叙述正确的是( )
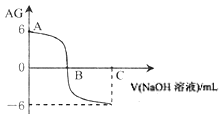
A. B点时c(X-) >c(Na+)
B. 室温时0.01 mol·L-1的HX溶液pH=6
C. A点时溶液中水的电离程度大于纯水的电离程度
D. 若C点时加入NaOH溶液40 mL,所得溶液中:c(X-)+2 c(HX) = c(OH-) - c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究Na2S 溶液与KMnO4溶液反应,探究过程如下
实验序号 | I | II |
实验过程 |
|
|
实验现象 | 紫色变浅(pH | 溶液呈淡黄色(pH |
资料: i.MnO4-在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2
ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法正确的是
A. 根据实验可知,Na2S被还原
B. 取实验I中少量溶液进行实验,检测到有SO42-,得出S2-被氧化成SO42-
C. 实验I中反应离子方程式: 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
D. 实验II 中反应结束后溶液呈淡黄色,有MnO2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com