
| A. | O2的相对分子质量为32 | |
| B. | 1molCO2的质量为44g/mol | |
| C. | H2SO4的摩尔质量为98 | |
| D. | 标准状况下,气体摩尔体积约为22.4L |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 原生铜的硫化物具有还原性 | |
| B. | 常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 | |
| C. | 铜蓝的形成过程是:ZnS(S)+Cu2+?CuS(S)+Zn2+ | |
| D. | 硝酸型酸雨不利于铜蓝的形成:CuS+2H+═Cu2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大c(CH3COOH),b增大 | B. | 加水稀释,b减小 | ||
| C. | b的大小只与温度有关 | D. | 以上说法均不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
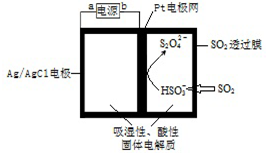
| A. | 阴极发生氧化反应 | |
| B. | 当电路中电子转移为5×10-5mol时,进入传感器的SO2为 1.12 mL | |
| C. | 正极反应式 Ag-e-=Ag+ | |
| D. | b为电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
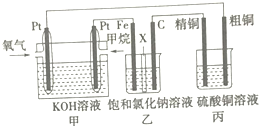 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com