
 .向碳酸氢铵溶液中加入足量的NaOH溶液:NH4+ +OH-= NH3·H2O
.向碳酸氢铵溶液中加入足量的NaOH溶液:NH4+ +OH-= NH3·H2O 科目:高中化学 来源:不详 题型:填空题
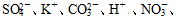 HCO3-、Cl-等离子中的若干种。然后又作了如下的实验分析:
HCO3-、Cl-等离子中的若干种。然后又作了如下的实验分析: ____________。
____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在pH=5的CH3COONa与CH3COOH混合液中,c(Na+)>c(CH3COO-) |
| B.澄清石灰水与足量小苏打溶液混合:Ca2++OH-+HCO-3=CaCO3↓+H2O |
| C.在与铝反应能生成H2的溶液中,NO—3、Fe2+、Na+一定不能大量共存 |
| D.除去氯化镁溶液中的Fe3+需向溶液中加入适量NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO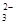 SO SO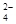 |
 酸。
酸。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 (HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式_________________________在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式_________________________在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )
)| A. K2CO3、BaCl2 | B.NaOH、CuSO4 |
| C. AgNO3、NaCl | D. Na2CO3、CaCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Fe + CuS O4 =" Cu" + FeSO4 O4 =" Cu" + FeSO4 | B.2Na + Cl2 2 NaCl 2 NaCl |
| C.NaCl + AgNO3 =" AgCl↓+" NaNO3 | D.2KClO3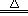 2KCl + 3O2↑ 2KCl + 3O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 含有的物质是 (以上物质均写化学式),写出第①步中反应的化学方程式:
含有的物质是 (以上物质均写化学式),写出第①步中反应的化学方程式:  ,
,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.镁与极稀硝酸反应生成硝酸铵的离子方程式为: 4Mg+6H++NO3- =4Mg2++NH4++3H2O |
| B.25℃时,将20 mL 0.1mol·L-1H2SO4溶液和30 mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11 |
| C.将10 mL 0.1 mol·L-1KAI(SO4)2溶液和10 mL0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
| D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com