
【题目】已知A、B、C、D原子序数依次递增的短周期主族元素,常温常压下AB2是一种红棕色气体,B与C同主族,则:
(1)C元素在周期表中的位置____________。
(2)画出D元素的简单离子结构示意图_______________________。
(3)将CB2与D2以体积比1:1混合后通入品红溶液中,品红溶液不褪色,请用一个化学方程式来解释:_________________________________。
(4)AB2与水反应的化学方程式为___________,在一定温度和压强下,将一个容积为15mL的试管充满AB2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,相同条件下再通入O2,若要使试管液面仍保持在原高度,则应通入的O2为___________mL。
(5)甲、乙、丙均为含A元素的化合物,丁为单质,甲、乙、丙、丁四种物质有如下转化关系(反应条件及部分产物已略去)
![]()
①若丁为一种常见的非金属单质,甲为氢化物,乙为氧化物,则一个乙分子所含有的电子数目___________。
②若丁为一种常见的金属单质,常温下丁在甲的浓溶液中能反应但很快停止,则丙的化学式___________。
【答案】第三周期ⅥA族 ![]() SO2 +Cl2+2H2O=H2SO4 +2HCl 3NO2 + H2O=2HNO3 + NO 8.75 15 Fe(NO3)2
SO2 +Cl2+2H2O=H2SO4 +2HCl 3NO2 + H2O=2HNO3 + NO 8.75 15 Fe(NO3)2
【解析】
由常温常压下AB2是一种红棕色气体可知,A为N元素、B为O元素;由B与C同主族可知,C为S元素;由A、B、C、D是原子序数依次递增的短周期主族元素可知,D为Cl元素。
(1) C为S元素,位于周期表第三周期ⅥA族,故答案为:第三周期ⅥA族;
(2)D为Cl元素,Cl原子得到一个电子形成Cl—,离子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(3)SO2与Cl2以体积比1:1反应生成硫酸和盐酸,反应的化学方程式为SO2 + Cl2 +2H2O = H2SO4 + 2HCl,故答案为:SO2 + Cl2 +2H2O = H2SO4 + 2HCl;
(4)NO2与水反应生成硝酸和一氧化氮,反应的化学方程式为3NO2 +H2O =2HNO3 +NO;在一定温度和压强下,将一个容积为15mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,试管中NO体积为![]() =5mL,相同条件下通入O2,NO先与O2发生反应4NO+3O2+2H2O =4HNO3使试管中无气体溶液全充满,此时通入O2的体积为
=5mL,相同条件下通入O2,NO先与O2发生反应4NO+3O2+2H2O =4HNO3使试管中无气体溶液全充满,此时通入O2的体积为![]() =3.75mL,再通入5mLO2使试管液面仍保持在原高度,则通入O2的体积为(5mL+3.75mL)=8.75mL,故答案为:3NO2 +H2O =2HNO3 +NO;8.75;
=3.75mL,再通入5mLO2使试管液面仍保持在原高度,则通入O2的体积为(5mL+3.75mL)=8.75mL,故答案为:3NO2 +H2O =2HNO3 +NO;8.75;
(5)由题意甲、乙、丙均为含N元素的化合物。
①若丁为一种常见的非金属单质,甲为氢化物,乙为氧化物,则甲为NH3、丁为O2、乙为NO、丙为NO2,1个NO分子含有15个电子,故答案为:15;
②若丁为一种常见的金属单质,常温下丁在甲的浓溶液中能反应但很快停止,则丁为Fe、甲为浓HNO3、乙为Fe(NO3)3、丙为Fe(NO3)2,故答案为:Fe(NO3)2。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。

下列各表述与示意图一致的是
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图①中使用的NaOH的浓度为2mol/L
C. 图②中物质A反应生成物质C,△H>0
D. 图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①②③三种不同的环境中

请回答:
(1)金属腐蚀主要分为__________腐蚀和_____________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是_________________(填序号)。
(3)①中正极的电极反应式为_________________________________________________,②中负极的电极反应式为_________________________________________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有__________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与铜条连接 ④将钢管用导线与碳棒连接
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
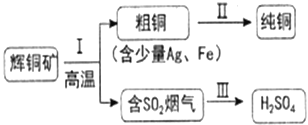
(1)Cu2S中Cu元素的化合价是__________价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的_________极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是__________________________。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
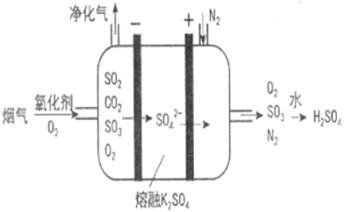
①在阴极放电的物质________________。
②在阳极生成SO3的电极反应式是_______________________________。
(4)检测烟气中SO2脱除率的步骤如下:
(i).将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
(ii)加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
(iii)过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示(i)中溴水的主要作用________________________________。
②若沉淀的质量越大,说明SO2的脱除率越________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列微粒的电子式:
(1)NH4+:____________; CO2:__________;NaOH:________________ 。
(2)若2.6g乙炔(C2H2气态)完全燃烧生成液态水和CO2时放热130kJ。则此反应的热化学方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
锌片:2Zn﹣4e﹣+4OH﹣═2ZnO+2H2O 石墨:2H2O+O2+4e﹣═4OH﹣
下列说法中不正确的是( )

A.电子从石墨经外电路流向锌片,电解质溶液为酸性溶液
B.锌片是负极,石墨是正极
C.电池总反应为2Zn+O2═2ZnO
D.该原电池工作一段时间后石墨附近溶液中的c(OH﹣)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉 淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正 确的是

A. O~A段反应的化方程式是Ba(OH)2+CO2=BaCO3↓+H2O
B. B~C段反应的离子方程式是2AlO2- +3H2O+CO2=2Al(OH)3↓+CO32-
C. A~B段与C~D段所发生的反应相同
D. D~E段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止食品受潮及富脂食品氧化变质,在包装袋中应放入的独立包装的物质是
A. 无水硫酸铜、蔗糖 B. 食盐、硫酸亚铁
C. 生石灰、还原铁粉 D. 生石灰、食盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com