
【题目】辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
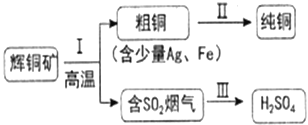
(1)Cu2S中Cu元素的化合价是__________价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的_________极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是__________________________。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
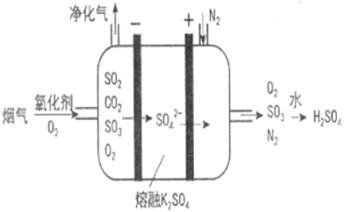
①在阴极放电的物质________________。
②在阳极生成SO3的电极反应式是_______________________________。
(4)检测烟气中SO2脱除率的步骤如下:
(i).将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
(ii)加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
(iii)过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示(i)中溴水的主要作用________________________________。
②若沉淀的质量越大,说明SO2的脱除率越________(填“高”或“低”)。
【答案】 +1 正 Cu2+的氧化性大于Fe2+的氧化性 O2 2SO42--4e-= 2SO3↑ + O2 SO32- +Br2+H2O=SO42- +Br- + 2H+ 或SO32-+ Br2+2OH-= SO42-+ 2Br-+ H2O 等 低
【解析】试题(1)Cu2S 中S为-2价,Cu为+1价。
(2)①电解法精炼铜时,粗铜做阳极,精铜做阴极,
②Cu2+比溶液中其他阳离子氧化性更强,浓度更大,在阴极放电,析出铜单质。
(3)①阴极发生还原反应,根据图中所示过程,烟气中O2发生还原反应,
②根据图中所示过程,SO42-放电生成SO3和O2,则阳极的电极反应式是2SO42--4e-=2SO3↑+O2↑。
(4)①溴水将溶液中的SO32-氧化成SO42-,则溴水的主要作用是Br2+SO32-+2OH-= 2Br-+SO42-+ H2O;
②沉淀量越大,说明净化气中硫元素质量分数越大,说明SO2脱除率越低。


科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验,实验现象:a处试纸变蓝;b处变红,局部褪色;c处无明显变化;d处试纸变蓝。下列对实验现象的解释或推测不合理的是

A. a为电解池的阴极 B. b处有氯气生成,且与水反应生成了盐酸和次氯酸
C. c处发生了反应:Fe-3e-=Fe3+ D. d处:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有丰富多彩的化学性质。回答下列问题:
(1)铁元素在周期表中的位置为第______周期_____族。
(2)FeCl3溶液可用于吸收尾气中的SO2,写出该反应的离子方程式:_________。
(3)某化学兴趣小组同学用如图装置,充分加热硫酸亚铁晶体(FeSO4·xH2O)至完全分解。

① 装置A中需持续通入N2,其目的是______________________________。
② 充分反应一段时间后,小组同学观察到实验现象为:装置A中残留有红棕色固体,装置B中固体变蓝,C中溶液褪色,请写出FeSO4分解的化学方程式:______________。
③ 装置D中干燥管的作用为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D原子序数依次递增的短周期主族元素,常温常压下AB2是一种红棕色气体,B与C同主族,则:
(1)C元素在周期表中的位置____________。
(2)画出D元素的简单离子结构示意图_______________________。
(3)将CB2与D2以体积比1:1混合后通入品红溶液中,品红溶液不褪色,请用一个化学方程式来解释:_________________________________。
(4)AB2与水反应的化学方程式为___________,在一定温度和压强下,将一个容积为15mL的试管充满AB2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,相同条件下再通入O2,若要使试管液面仍保持在原高度,则应通入的O2为___________mL。
(5)甲、乙、丙均为含A元素的化合物,丁为单质,甲、乙、丙、丁四种物质有如下转化关系(反应条件及部分产物已略去)
![]()
①若丁为一种常见的非金属单质,甲为氢化物,乙为氧化物,则一个乙分子所含有的电子数目___________。
②若丁为一种常见的金属单质,常温下丁在甲的浓溶液中能反应但很快停止,则丙的化学式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向1体积pH=2的盐酸中加入10体积pH= 11 的氢氧化钠溶液,若所得溶液中pH是( )
A.约为2.3B.7C.约为10D.6.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中,下列各组离子能够大量共存的是( )
A.K+、Ba2+、Cl-、SO42-B.H+、HCO3-、Cl-、K+
C.Cl-、Na+、NO3-、Ca2+D.Cu2+、NO3-、SO4-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在甲、乙、丙三个体积相等且恒容的密闭容器中发生反应:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)。投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+NO(g)。投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/(mol·L-1) | 0.10 | 0.20 | 0.20 |
c(SO2)/(mol·L-1) | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2min的平均速率v(NO)=0.05mol·L-1·min-1
B. 容器乙中若起始时改充0.10mol·L-1NO2和0.20mol·L-1SO2,达到平时c(NO)与原平衡相同
C. 达到平衡时,容器丙中SO3的体积分数是容器甲中SO3的体积分数的2倍
D. 达到平衡时,容器乙中NO2的转化率和容器丙中NO2的转化率相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com