
【题目】用石墨电极完成下列电解实验,实验现象:a处试纸变蓝;b处变红,局部褪色;c处无明显变化;d处试纸变蓝。下列对实验现象的解释或推测不合理的是

A. a为电解池的阴极 B. b处有氯气生成,且与水反应生成了盐酸和次氯酸
C. c处发生了反应:Fe-3e-=Fe3+ D. d处:2H++2e-=H2↑
【答案】C
【解析】a处试纸变蓝,为阴极,有氢氧根产生,氢离子放电;b处变红,局部褪色,氯离子放电产生氯气,为阳极;c处无明显变化,铁失去电子;d处试纸变蓝,有氢氧根产生,氢离子放电,据此解答。
A.a处试纸变蓝,为阴极,生成OH-,氢离子放电,电极方程式为2H++2e-=H2↑,A正确;
B.b处变红,局部褪色,是因为氯离子放电产生氯气,氯气溶于水发生反应Cl2+H2O=HCl+HClO,HCl的酸性使溶液变红,HClO的漂白性使局部褪色,B正确;
C.Fe为c阳极,发生反应:Fe-2e- =Fe2+,C错误;
D.d处试纸变蓝,为阴极,生成OH-,氢离子放电,电极方程式为2H++2e-=H2↑,D正确;
答案为C。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s) 时刻测得各物质的浓度如下表。下列结论正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A) / (mol·L-1) | 6 | 3 | 2 | 2 |
c(B) / (mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C) / (mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t3时刻反应已经停止
B. t3~t4内正、逆反应速率不相等
C. 在容器中发生的反应为A + B![]() C
C
D. 在t2~t3内A的平均反应速率为![]() mol·L-1·s-1
mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 任何化学反应不一定都有反应热
B. 使用催化剂可以改变反应的平衡常数
C. 升高温度使反应加快,是因为降低了反应的活化能
D. 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:①Cr2O72-+H2O![]() 2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)碱溶的目的是__________,所加40%NaOH不宜过量太多的原因是______________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_____________。
(3)使用下列用品来测定溶液的pH,合理的是_____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。

①图中仪器A的名称为_______。
②在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:___________。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体_____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是
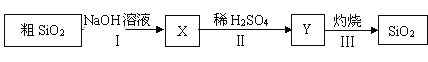
A. X可用作木材防火剂
B. 步骤Ⅱ中的稀硫酸可用CO2来代替
C. 步骤II的反应是Na2SiO3+ H2SO4 = H2SiO3(胶体) + Na2SO4
D. 步骤 Ⅲ若在实验室完成,一般在蒸发皿中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
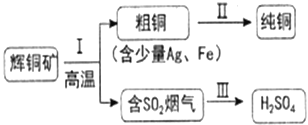
(1)Cu2S中Cu元素的化合价是__________价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的_________极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是__________________________。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
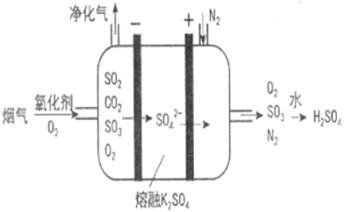
①在阴极放电的物质________________。
②在阳极生成SO3的电极反应式是_______________________________。
(4)检测烟气中SO2脱除率的步骤如下:
(i).将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
(ii)加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
(iii)过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示(i)中溴水的主要作用________________________________。
②若沉淀的质量越大,说明SO2的脱除率越________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾 病的药物。以2氯苯甲醛为原料合成该药物的路线如下:

(1)A中官能团名称为_____,A发生银镜反应的化学方程式为_____。
(2)C生成D的反应类型为_____。
(3)X(C6H7BrS)的结构简式为_____。
(4)写出C聚合成高分子化合物的化学反应方程式:_____。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有______种。
①除苯环之外无其他环状结构;②能发生银镜反应。 其中核磁共振氢谱中有5个吸收峰,且峰值比为2∶2∶1∶1∶1的结构简式为_____。
(6)已知: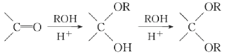 ,写出以乙烯、甲醇为有机原料制备化 合物
,写出以乙烯、甲醇为有机原料制备化 合物![]() 的合成路线(无机试剂任选)__________
的合成路线(无机试剂任选)__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com