
【题目】下列物质检验或除杂方法正确的是
A. 用H2除去乙烷中的乙烯
B. 用NaOH除去乙酸乙酯中的乙酸
C. 用银氨溶液检验淀粉是否完全水解
D. 用水除去乙烯中混有的乙醇蒸气
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法 F 渗析法
①_____分离饱和食盐水与沙子的混合物。
②_____分离水和汽油的混合物。
③_____分离四氯化碳(沸点为 76.75℃)和甲苯(沸点为 110.6℃)的混合物。
④_____从碘的水溶液里提取碘。
⑤_____从硝酸钾和氯化钠的混合液中获得硝酸钾。
Ⅱ.下图是某同学设计的蒸馏装置图
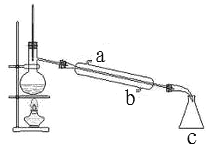
①进水口是_____(a 或 b)。
②装置 c 的名称是_____。
③蒸馏烧瓶中常加入沸石或碎瓷片,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素在元素周期表中的位置,取决于元素原子的( )
A.相对原子质量和核电荷数B.电子层数和中子数
C.电子层数和最外层电子数D.电子层数和核外电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的各种叙述中,下列说法中正确的是( )
A.在离子化合物里,只存在离子键
B.共价化合物里,一定不存在离子键
C.非极性键只存在于双原子的单质分子里
D.由非金属元素组成的化合物中只存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2=NaBO2 +6H2O,有关的说法不正确的是

A. 纳米MnO2层的作用是提高原电池的工作效率
B. 放电过程中,Na+从B极区移向A极区
C. 电池负极的电极反应为:BH4 +8OH- - 8e一 =BO2-+6H2O
D. 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜与浓硫酸的反应中,如果转移0.4mol电子,则被还原的硫酸物质的量
A. 0.4mol B. 0.2mol
C. 小于0.4mol D. 小于0.2 mol
【答案】B
【解析】
铜与浓硫酸的反应中,铜元素化合价升高,失去电子,硫元素化合价降低,得到电子,得失电子总数是相等的,均为0.4mol。
Cu和浓硫酸反应方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,由方程式可知,1mol硫酸被还原时转移电子物质的量=1mol×(6-4)=2mol,所以如果电子转移0.4mol,则被还原的硫酸的物质的量0.2mol,答案选B。
CuSO4+SO2↑+2H2O,由方程式可知,1mol硫酸被还原时转移电子物质的量=1mol×(6-4)=2mol,所以如果电子转移0.4mol,则被还原的硫酸的物质的量0.2mol,答案选B。
【点睛】
本题考查氧化还原反应的计算,侧重考查分析计算能力,知道作氧化剂的浓硫酸和转移电子的关系,明确浓硫酸的作用是解本题关键。
【题型】单选题
【结束】
18
【题目】下列离子方程式书写正确的是
A. 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-![]() NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
C. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. 向FeO中加入稀硫酸:2FeO + 8H+ + SO42- =2Fe3+ + SO2 ↑+ 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在工农业生产中有重要的作用。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol;
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原Fe2O3的热化学方程式为__________________________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的新举措,反应原理:CO(g)+2H2(g)![]() CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
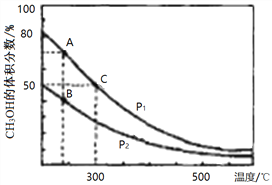
①在上图A、B、C三点中,选出对应下表物理量最小的点。
反应速率 | 平衡常数K | 平衡转化率α |
_________ | _________ | _________ |
②在300℃时,向C点平衡体系中再充入0. 5molCO、1.0molH2和0.5mol的CH3OH,该反应向_________方向进行(填“正反应”、‘逆反应”或“不移动”)。
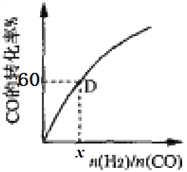
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系图所示,测得D点氢气的转化率为40%,则x=_____________。
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38]
(4)莫尔盐,即六水合硫酸亚铁铵晶体,是一种重要的化工原料,在空气中缓慢风化及氧化,欲证明一瓶久置的莫尔盐已经部分氧化,需要进行实验操作是:取少量样品,加无氧水溶解,将溶液分成两份,______________________________________,则证明该样品已部分氧化。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com