
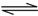 2NH3(g)的△H= 。
2NH3(g)的△H= 。 积分数为 。
积分数为 。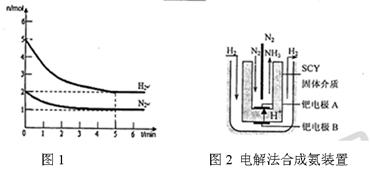
 内外
内外 表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A
表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A 上发生的电极反应式是 。
上发生的电极反应式是 。  天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
 CH3OH (g) ΔH=-90.8 kJ·mol-1
CH3OH (g) ΔH=-90.8 kJ·mol-1 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1 CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1| A.高温高压 |
| B.加入催化剂 |
| C.减少CO2的浓度 |
| D.增加CO的浓度E.分离出二甲醚 |
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KW随溶液温度、浓度的改变而改变 |
| B.凡是氧化还原反应,都是放热反应 |
| C.对已达到化学平衡的反应,改变压强,平衡一定改变 |
| D.弱电解质的电离程度,与温度、浓度均有关系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+C(s),T=980 K时,ΔH-TΔS=0,当体系温度低于980 K时,估计ΔH-TΔS应__________0(填“大于”“小于”或“等于”),该反应________________进行;当体系温度高于980 K时,ΔH-TΔS应________________0。在冶金工业中,以碳作还原剂,温度高于980 K时的氧化产物以________________为主,低于980 K时以________________为主。
CO2(g)+C(s),T=980 K时,ΔH-TΔS=0,当体系温度低于980 K时,估计ΔH-TΔS应__________0(填“大于”“小于”或“等于”),该反应________________进行;当体系温度高于980 K时,ΔH-TΔS应________________0。在冶金工业中,以碳作还原剂,温度高于980 K时的氧化产物以________________为主,低于980 K时以________________为主。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.升高温度、降低压强、增加氮气 | B.降低温度、增大压强、加入催化剂 |
| C.升高温度、增大压强、增加氮气 | D.降低温度、增大压强、分离出部分氨 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z ,达到平衡后, X的转化率不可能为
2Z ,达到平衡后, X的转化率不可能为| A.10% | B.15% | C.20% | D.25% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热 | B.不用稀硫酸,改用质量分数为98%的浓硫酸 |
| C.不用铁片,改用镁条 | D.不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com