
【题目】Ⅰ、如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
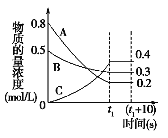
(1)该反应的化学方程式为___________________。
(2)0~t1s 内B气体的平均反应速率为_________。
(3)(t1+10)s 时,A的转化率为___________。
(4)关于该反应的说法正确的是___________。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积大小的锌片、同浓度盐酸做了下列平行实验:
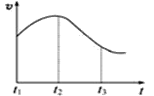
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ______________________,t2~t3速率变化的主要原因是 ______________________。
(2)实验②放出氢气的量减少的原因是 ______________________________。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?_________(填“正确”或“不正确”)。请选择下列相应的a或b作答。_________
a、若不正确,请说明原因: 。
b、若正确则写出实验③中原电池的正极电极反应式 。
【答案】 3A+B![]() 2C
2C ![]() mol·L-1·s-1 75% bc 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小,反应速度减慢 Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少 正确 2H+ + 2e-=H2↑
mol·L-1·s-1 75% bc 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小,反应速度减慢 Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少 正确 2H+ + 2e-=H2↑
【解析】Ⅰ、(1)由图象可知A、B的浓度降低,A、B为反应物,A的浓度变化量为0.8mol/L-0.2mol/L=0.6mol/L,B的浓度变化量为0.5mol/L-0.3mol/L=0.2mol/L,C的浓度增大为生成物,C的浓度变化量为0.4mol/L,浓度变化量之比等于化学计量数之比,故A、B、C的化学计量数之比为0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,故反应方程式为:3A+B2C;故答案为:3A+B2C;
(2)0~t1s 内B气体的平均反应速率V=![]() =
=![]() =
=![]() mol/(Ls),故答案为:
mol/(Ls),故答案为: ![]() mol/(Ls);
mol/(Ls);
(3)(t1+10)s 时,平衡没有发生移动,所以A的转化率为![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(4)a.到达t1时刻该反应达平衡但没有停止,故错误;b.在t1时刻之前,反应向正反应方向移动,所以B气体的消耗速率大于它的生成速率,故正确;c.在t1时刻达平衡,正逆反应速率相等,所以C气体的正反应速率等于逆反应速率,故正确;故选:bc;
II、(1)开始温度起主要作用,纯锌与稀盐酸反应,放出热量,温度升高,t1~t2速率加快;后期c(H+)起主导作用,随着反应进行c(H+)降低,t2~t3反应速率减慢,故答案为:反应放热,溶液温度升高,反应速率加快;随反应进行,盐酸的浓度减小较大,反应速度减慢;
(2)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少,生成氢气量减少,故答案为:Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少;
(3)实验③中锌与铜离子发生置换反应生成金属铜,生成的铜与锌形成了原电池,锌为负极,铜为正极,负极电极反应式为:Zn-2e-=Zn2+,H+在正极发生还原反应,电极反应式为:2H++2e-=H2↑,故答案为:正确;2H++2e-=H2↑。


科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A相对分子质量为140,其中碳的质量分数为85.7%。A分子中有两个碳原子不与氢原子直接相连。A在一定条件下氧化只生成G,G能使紫色石蕊试液变红。已知:

请回答下列问题:
⑴A的结构简式____________________ G的结构简式:____________________。
⑵G的酯类同分异构体(不含立体异构)有_____________________种,写出其中核磁共振氢谱中有三种峰,且峰的面积之比等于6:3:1的结构简式 ___________________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟号”载人航天器中宇航员所在的轨道和返回仓都是密封的,宇航员吸入氧气、呼出二氧化碳,如果二氧化碳浓度过高,会使宇航员困乏,呼吸频率加快,严重的还会窒息,为解决此问题,应在航天仓中加入( )
A.Na2O2 B.Na2CO3
C.NaOH D.高压氧气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联苯的结构简式如右图(![]() ),下列有关联苯的说法中正确的是( )
),下列有关联苯的说法中正确的是( )
A. 它和蒽(![]() )同属于芳香烃,两者互为同系物
)同属于芳香烃,两者互为同系物
B. 联苯的一氯代物有4种
C. 1mol联苯最多可以和6molH2发生加成反应
D. 它容易发生加成反应、取代反应,也容易被强氧化剂(如:酸性KMnO4溶液)氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分

(1)①~⑦元素中金属性最强的元素是___________(用元素符号表示)。
(2)④与⑤形成的化合物的电子式为____________。
(3)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(4)表中元素②的单质与③的最高价含氧酸的浓溶液反应的化学方程式为___________________。
(5)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为垃,该元素在元素周期表中的位置是_____________,属于______元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______。
(6)核内中子数为N的R![]() ,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________mol。
,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 煤经过分馏可得到焦炭、 煤焦油和焦炉气
B. 石油裂化是为了获得更多的汽油
C. 医用酒精的浓度通常为 95%
D. 甲烷、 汽油、 酒精都是可燃性烃, 都可作燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com