
【题目】“神舟号”载人航天器中宇航员所在的轨道和返回仓都是密封的,宇航员吸入氧气、呼出二氧化碳,如果二氧化碳浓度过高,会使宇航员困乏,呼吸频率加快,严重的还会窒息,为解决此问题,应在航天仓中加入( )
A.Na2O2 B.Na2CO3
C.NaOH D.高压氧气瓶
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
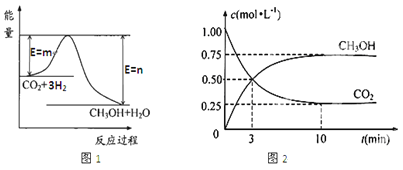
(1)该反应为_________热反应,原因是_____________________。
(2)下列能说明该反应已经达到平衡状态的是_________(填序号)
A.v (H2)=3v(CO2) B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内气体密度保持不变
E.CH3OH 中1 mol H—O键断裂的同时2 mol C=O键断裂
F. 混合气体的平均摩尔质量不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=________。 达平衡时容器内平衡时与起始时的压强比____________。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应为________________,
与铅蓄电池相比,当消耗相同质量的负极物质时,甲醇燃料电池的理论放电量是铅蓄电池的___________倍(保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构说法正确的是
A. 氯化钠固体中的离子键在溶于水时被破坏
B. 碘升华时克服了共价键和分子间作用力
C. 含极性键的共价化合物一定是电解质
D. HF的分子间作用力大于HCl,故HF比HCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.胶体粒子的直径介于1~100 nm之间
B.胶体不均一,不稳定,静置后易产生沉淀
C.可用过滤的方法除去蔗糖溶液中含有的少量淀粉胶体
D.Fe(OH)3胶体不能与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
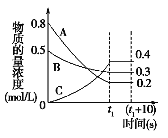
(1)该反应的化学方程式为___________________。
(2)0~t1s 内B气体的平均反应速率为_________。
(3)(t1+10)s 时,A的转化率为___________。
(4)关于该反应的说法正确的是___________。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积大小的锌片、同浓度盐酸做了下列平行实验:
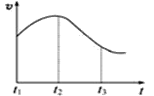
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ______________________,t2~t3速率变化的主要原因是 ______________________。
(2)实验②放出氢气的量减少的原因是 ______________________________。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?_________(填“正确”或“不正确”)。请选择下列相应的a或b作答。_________
a、若不正确,请说明原因: 。
b、若正确则写出实验③中原电池的正极电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,E(g)+F(g)![]() R(g)+N(g)的平衡常数K=4/9。该温度下在A、B、C三个恒容密闭容器中,投入E(g)、F(g),其起始浓度如下表,下列判断正确的是( )
R(g)+N(g)的平衡常数K=4/9。该温度下在A、B、C三个恒容密闭容器中,投入E(g)、F(g),其起始浓度如下表,下列判断正确的是( )
起始浓度 | A | B | C |
c (E)/ molL-1 | 0.010 | 0.020 | 0.020 |
c (F)/ molL-1 | 0.010 | 0.010 | 0.020 |
A. 平衡时,B中E的转化率为大于40%
B. 平衡时,A中和C中F的转化率均为40%
C. 平衡时,C中c(R)是A中的2倍,为0.012molL-1
D. 反应开始时A和C中反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应:A(s)+2B(g) ![]() C(g)+2D(g) △H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是:
C(g)+2D(g) △H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是:
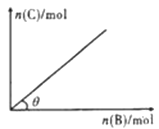
A. 增加A的物质的量,正反应速率加快
B. 平衡时,其他条件不变,当温度升高时,转化率变大
C. 图中曲线的斜率表示反应的化学平衡常数
D. 平衡时,其他条件不变,再通人B,则反应混合物的温度升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com