
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
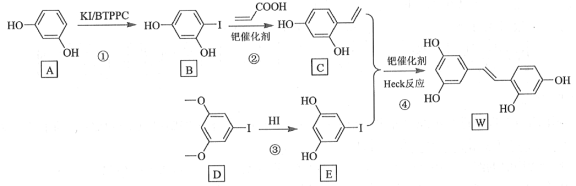
回答下列问题:
(1)A的化学名称为___________。
(2)![]() 中的官能团名称是___________。
中的官能团名称是___________。
(3)反应③的类型为___________,W的分子式为___________。
(4)不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率/% |
1 | KOH | DMF | Pd(OAc)2 | 22.3 |
2 | K2CO3 | DMF | Pd(OAc)2 | 10.5 |
3 | Et3N | DMF | Pd(OAc)2 | 12.4 |
4 | 六氢吡啶 | DMF | Pd(OAc)2 | 31.2 |
5 | 六氢吡啶 | DMA | Pd(OAc)2 | 38.6 |
6 | 六氢吡啶 | NMP | Pd(OAc)2 | 24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③1 mol的X与足量金属Na反应可生成2 g H2。
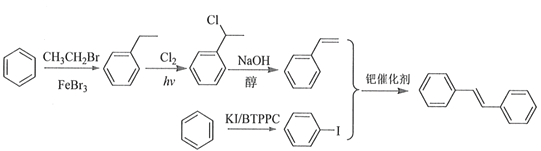
(6)利用Heck反应,由苯和溴乙烷为原料制备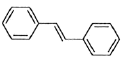 ,写出合成路线________________。(无机试剂任选)
,写出合成路线________________。(无机试剂任选)
【答案】间苯二酚(1,3-苯二酚) 羧基、碳碳双键 取代反应 C14H12O4 不同碱 不同溶剂 不同催化剂(或温度等) (5)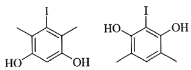 (6)
(6)
【解析】
首先看到合成路线:由A物质经反应①在酚羟基的邻位上了一个碘原子,发生了取代反应生成了B物质,B物质与丙烯酸在催化剂的作用下生成了C物质,那C物质就是将丙烯酸中的羧基去掉取代了碘原子的位置;由D反应生成E就是把HI中的H连在了O上,发生的是取代反应;最后heck反应生成W物质。
(1)A物质所含官能团是两个酚羟基,且苯环上有两个是间位的取代基,那物质的命名就是间苯二酚或1,3-苯二酚;
(2)![]() 物质中含有的官能团是碳碳双键和羧基
物质中含有的官能团是碳碳双键和羧基
(3)D物质到E物质没有双键的消失,且在O原子处增加了氢原子,没有双键参与反应所以属于取代反应,W物质中可以轻松数出共有14个C原子,4个氧原子,氢原子的个数可以通过不饱和度来推断出,14个碳的烷应该有30个氢,现在该分子有9个不饱和度,其中一个苯环4个,一个双键1个,一个不饱和度少2个氢,所以30-9×2=12,因此有12个氢原子,即分子式为C14H12O4。
(4)可以从表格中寻找溶剂一样的实验、碱一样的实验发现得出:实验1,2,3探究了不同碱对反应的影响;实验4,5,6探究了不同溶剂对反应的影响,最后只剩下不同催化剂对实验的影响。
(5)D的分子式为:C8H9O2I,要求含苯环,那支链最多含两个C,且1molX与足量Na反应可生成2g氢气,那就证明有两个酚羟基或醇羟基,又有三种不同环境的氢6:2:1,那一定是有两个甲基和两个酚羟基,因为醇羟基没有6个相同环境的氢,则符合条件的有机物结构简式为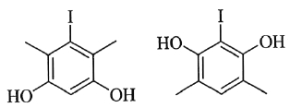 。
。
(6)由题意中的heck反应可知需要一个反应物中含双建,一个反应物中含I;从苯出发可以经过溴乙烷和溴化铁的反应制得乙苯,乙苯在乙基上通过烷烃的取代反应引入氯原子,卤代烃在氢氧化钠醇溶液中发生消去反应产生双键,得到苯乙烯;可以仿照反应①通过相同条件在苯环上引入一个碘原子,因此合成路线图为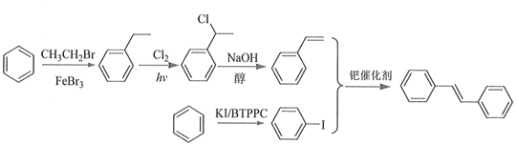 。
。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.已知石墨比金刚石稳定,则反应C(石墨,s)=C(金刚石,s)为放热反应
B.物质发生化学反应时都伴随能量变化,则伴随能量变化的物质变化也一定是化学变化
C.相同条件下,如果1mol氧原子所具有的能量为E1,1mol氧分子所具有的能量为E2,则2E1=E2
D.已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
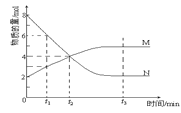
A.反应的化学方程式:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)a、b、c三种元素的原子半径由大到小的顺序是___(填元素符号);b、f、h三种元素对应简单氢化物的热稳定性由强到弱的顺序是___(填化学式)。
(2)c、d、e三种元素最高价氧化物对应水化物中碱性最强的是___(填水化物的化学式)。
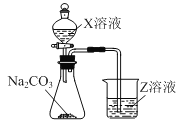
(3)利用如图装置可比较a、e、h的非金属性强弱,则装置中试剂X、Z分别为___(填化学式)。
(4)元素i的原子结构示意图为___;写出元素i的最高价氧化物对应水化物溶液与元素d的单质反应的离子方程式___。
(5)推测原子序数为34的元素在周期表中的位置___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____种,第一电离能比P大有____种。
(3)PH3分子的空间构型为___________。PH3的键角小于NH3的原因是__________。
(4)化合物(CH3)3N能溶于水,试解析其原因____________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为________。
②已知晶胞边长a pm,阿伏加德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O==NaN3+NaOH+NH3,3NaNH2+NaNO3==NaN3+3NaOH+NH3↑。
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是________,第一电离能最小的元素是_______。
(2)基态氮原子的L层电子排布图为_________________。
(3)与N3-互为等电子体的分子为_________(写出一种)。依据价层电子对互斥理论,NO3-的空间构型是______________,其中心原子杂化类型是__________。
(4)叠氮化钠中不含有的化学键类型有_____________。
A.离子键 B.极性共价键 C.σ键 D.π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列试管实验操作及现象,得出“实验结论”正确是
选项 | 试管实验操作及现象 | 实验结论 |
A | 向某溶液中加入AgNO3溶液,有白色沉淀生成 | 该溶液中一定含有Cl- |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入盐酸无现象,再加入BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有 |
D | 向某溶液中加入稀氢氧化钠,用湿润的红色石蕊试纸靠近试管口,试纸未变蓝。 | 该溶液中一定不含 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的物质,且A、B、C均含有同一种元素,在一定条件下相互转化关系如下图所示(部分产物已略去)。请回答:
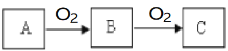
(1)若B是无色气体,C是红棕色气体。
① A、B、C所含相同元素在元素周期表中的位置是______。
② 下列说法正确的是______(填字母)。
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式__________________。
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
① A、B、C所含相同元素的原子结构示意图是______。
② 下列说法不正确的是______(填字母)。
a.A一定是黄色晶体
b.可以用上述转化关系制备硫酸
c.B与水反应做还原剂。
③C的水溶液与氢氧化钠的反应为______________(填吸热或放热)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
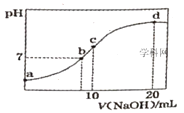
A.点a所示溶液中:c(NH4+)=2c(SO42-)>c(OH-)>c(H+)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O)>c(OH-)>c(NH4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com