
CO对合成NH3的催化剂有毒害作用,所以要除去,使之和水蒸气作用生成CO2和H2,若反应在1000 K进行:
(1)若起始c(H2O)是c(CO)的9倍,达到平衡时,CO的转化率是多少?
(2)欲使CO的转化率高于95%,问起始物中c(H2O)/c(CO)多大?(反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),K=0.627)
CO2(g)+H2(g),K=0.627)
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
 由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产.如:
由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产.如:| n(CO) |
| n(H2) |
| 实验序号 | T(℃) |
|
p(Mpa) | CO(转化率) | ||
| 1 | 150 |
|
0.1 | a | ||
| 2 | x |
|
5 | b |
| n(CO) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
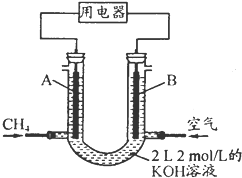 甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.| 1 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com