
【题目】药物(F)的合成路线如下:
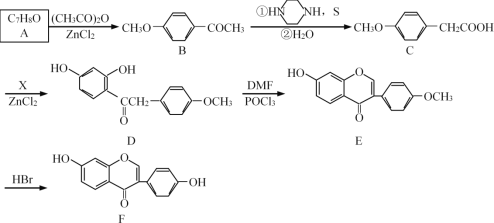
(1)化合物A的结构简式为_______;B中含有的官能团名称是_______。
(2)D的分子式为_______;E→F的反应类型为_______。
(3)A的一种同分异构体G,具有如下结构特点:①分子中含有苯环;②核磁共振氢谱共有5中峰,G的名称是_______。
(4)已知:C→D为取代反应,其另一产物为H2O,写出X的结构简式_______。
(5)根据已有知识并结合相关信息,写出以![]() 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体![]() 的合成路线流程图(无机试剂任用)_______。
的合成路线流程图(无机试剂任用)_______。
【答案】![]() 醚键、羰基 C15H14O4 取代反应 苯甲醇
醚键、羰基 C15H14O4 取代反应 苯甲醇 
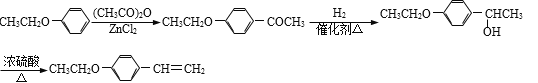
【解析】
(1)由A→B发生取代反应,结合B的结构简式![]() 推断A的结构简式和确定B中含有的官能团;
推断A的结构简式和确定B中含有的官能团;
(2)D的结构简式为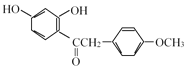 ,结合碳的四价理论,确定D的分子式;E→F的反应是
,结合碳的四价理论,确定D的分子式;E→F的反应是 与HBr反应生成了
与HBr反应生成了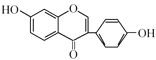 ,结合官能团的变化分析反应类型;
,结合官能团的变化分析反应类型;
(3)A的分子式为C7H8O,其同分异构体G中含有苯环,说明苯环上的取代基为-CH2OH或一个甲基与一个酚羟基,核磁共振氢谱共有5中峰,说明结构对称性较强,由此推断G的结构简式;
(4)C→D为取代反应,其另一产物为H2O,结合C和D的结构差异及原子守恒,推断另一种反应物的结构简式;
(5)以![]() 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体![]() 可利用题中信息
可利用题中信息![]() 和(CH3CO)2O在ZnCl2的催化作用下生成
和(CH3CO)2O在ZnCl2的催化作用下生成![]() ,再在催化剂作用下与H2发生羰基加成,即可生成
,再在催化剂作用下与H2发生羰基加成,即可生成![]() ,最后再发生醇的消去反应即可得到目标产物。
,最后再发生醇的消去反应即可得到目标产物。
(1)由A→B发生取代反应,结合B的结构简式![]() 可知A的结构简式为
可知A的结构简式为![]() ,B中含有的官能团有醚键、羰基;
,B中含有的官能团有醚键、羰基;
(2)D的结构简式为 ,其分子式为C15H14O4;E→F的反应是
,其分子式为C15H14O4;E→F的反应是 与HBr反应生成了
与HBr反应生成了 ,E中醚键上的甲基被氢原子所替代,生成了酚羟基,故发生的反应为取代反应;
,E中醚键上的甲基被氢原子所替代,生成了酚羟基,故发生的反应为取代反应;
(3)A的分子式为C7H8O,其同分异构体G中含有苯环,说明苯环上的取代基为-CH2OH或一个甲基与一个酚羟基,核磁共振氢谱共有5中峰,说明结构对称性较强,则满足条件的G的结构简式为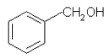 ,其化学名称为苯甲醇;
,其化学名称为苯甲醇;
(4)C→D为取代反应,其另一产物为H2O,结合![]() 和
和 的结构差异及原子守恒,另一种反应物X的结构简式为
的结构差异及原子守恒,另一种反应物X的结构简式为 ;
;
(5)以![]() 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体![]() 可利用题中信息
可利用题中信息![]() 和(CH3CO)2O在ZnCl2的催化作用下生成
和(CH3CO)2O在ZnCl2的催化作用下生成![]() ,再在催化剂作用下与H2发生羰基加成,即可生成
,再在催化剂作用下与H2发生羰基加成,即可生成![]() ,最后再发生醇的消去反应即可得到目标产物,具体的合成路线是
,最后再发生醇的消去反应即可得到目标产物,具体的合成路线是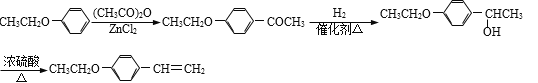 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁--空气燃料电池工作原理示意图。下列有关该电池的说法不正确的是( )

A.该电池Mg作负极,发生氧化反应
B.该电池的正极反应式为:![]()
C.电池工作时,电子通过导线由Mg电极流向C电极
D.当电路中通过0.2mol电子时,消耗的![]() 体积为1.12L
体积为1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。关于常温下pH=2的H2SO4溶液,溶液中不存在H2SO4分子,但存在HSO4一离子,下列说法错误的是
A.每升溶液中的H+数目为0.01NA
B.Na2SO4溶液中:c(Na+)=2c(SO42-)>c(H+)=2c(OH-)
C.向稀硫酸中逐滴滴加浓硫酸,溶液中![]() 减小
减小
D.NaHSO4不是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
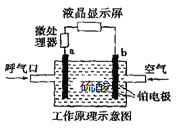
A.b为正极,电极反应式为:O2+2H2O+4e-=4OH-
B.电解质溶液中的H+移向呼气口
C.若有0.4mol电子转移,则在标准状况下消耗2.24L氧气
D.呼出气体中酒精含量越低,微处理器中通过的电流越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列有关有机化学的问题:
(1)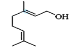 的分子式为__。
的分子式为__。
(2)苯与浓硫酸和浓硝酸混合加热产生硝基苯的反应方程式为__。
(3)某有机物的结构简式如图所示,根据结构简式回答下列问题:
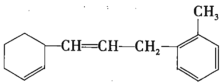
①1mol该物质和足量溴水混合,消耗Br2的物质的量为__mol。
②该物质苯环上的一氯代物有__种。
③下列说法不正确的是__(填序号)。
a.该有机物可发生加成、取代、氧化等反应
b.该有机物和苯属于同系物
c.该有机物使溴水褪色的原理与乙烯相同
d.该有机物能使酸性KMnO4溶液褪色,发生的是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() (a).
(a). ![]() (b).
(b). ![]() (c)的分式均为C5H6,下列有关叙述正确的是
(c)的分式均为C5H6,下列有关叙述正确的是
A. 符合分子式为C5H6的同分异构体只有a、b、c三种
B. a、b、c的一氯代物都只有三种
C. a、b、c都能使溴的CCl4溶液褪色,且褪色原理相同
D. a、b、c分子中的5个碳原子一定都处于同一个平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类可持续发展面临的重要问题,某科学家设计的UT-3热化学循环如下图所示:
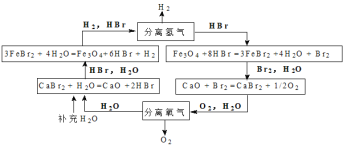
该过程最终制得的能源气体是
A.H2B.O2C.HBrD.Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱土金属指元素周期表中第ⅡA族元素,它们的单质和化合物用途较为广泛。
(1)铍元素能形成一种价格昂贵的宝石——祖母绿,其化学式为Be3Al2(SiO3)6,其中铍元素的化合价是________,基态铍原子的价电子排布式为________。
(2)镁是航天工业的重要材料。镁元素和相邻元素钠、铝的第一电离能的大小顺序为________。
(3)钙元素在自然界以化合物CaCl2、CaCO3、CaSO4、Ca(OH)2等形式存在。上述四种物质中只含有一种类型化学键的是________;CO32-的中心原子的杂化类型是________,空间构型是________。

(4)钡元素与氧元素能够形成一种化合物,其晶胞结构如图所示,该物质的化学式为________,Ba2+的配位数是________,若阿伏加德罗常数的值为NA,晶胞边长为a cm,则晶体的密度为________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com