
| D |
| D |

| O2 |
| O2 |
| 0.1mol |
| 4 |
| O2 |
| O2 |
| O2 |
| O2 |
| Fe |
| Fe |
| NaOH |
| NaOH |
| O2 |
| O2 |
| 0.1mol |
| 4 |
| O2 |
| O2 |
| O2 |
| O2 |
| ||
| △ |
| ||
| △ |
| Fe |
| Fe |
| NaOH |
| NaOH |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
| A、Ba2+、Na+、H+、Cl- |
| B、Na+、K+、SO32-、Cl- |
| C、Al3+、K+、Br-、HCO3- |
| D、Fe3+、Na+、H2O2、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中只存在离子键,没有共价键 |
| B、构成单质分子的粒子中一定含有共价键 |
| C、共价化合物分子中一定不存在离子键 |
| D、仅由非金属元素组成的化合物中一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
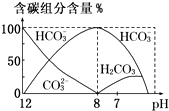 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
c(HC
| ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:

| KMnO4/H+ |
| 浓H2SO4 |
| △ |
 nCH=CH+nCH=CH
nCH=CH+nCH=CH| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com