
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有酸和碱之间的中和反应 |
| B、强酸溶液与强碱溶液生成可溶性盐和水的反应 |
| C、所有可溶性酸和可溶性碱之间的中和反应 |
| D、所有强酸和强碱之间的中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| 一定条件 |

| 一定条件 |
| ① |
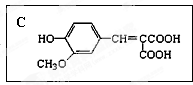
| 一定条件 |
| ② |

查看答案和解析>>
科目:高中化学 来源: 题型:
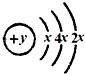 ;F的最外层电子数是电子层数的2倍.
;F的最外层电子数是电子层数的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:
| 探究内容 | 实验方案 | 实验现象 |
| 探究 Fe 2+ 具有还原性 | ||
| 探究 Fe 2+ 具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
B、在
| ||
| C、在0.1 mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
| D、在0.1 mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
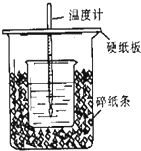 用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com