
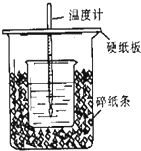
 用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| -Q |
| n(H2O) |
| -Q |
| n(H2O) |
| 2.5kJ |
| 0.05mol |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- |
| B、高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O |
| C、AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘化亚铁溶于稀硝酸中:3Fe2++4H++NO3-=3Fe3++NO↑+2 H2O | ||||
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | ||||
C、向沸水中滴入几滴饱和氯化铁溶液,并加热至溶液成红褐色:Fe3++3H2O
| ||||
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知醋酸是日常生活中常见的弱酸.
已知醋酸是日常生活中常见的弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
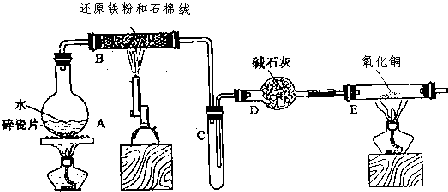
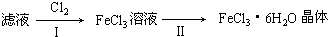
查看答案和解析>>
科目:高中化学 来源: 题型:
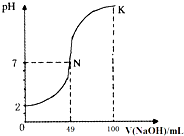 常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )| A、H2A为二元强酸 |
| B、K点时加水稀释溶液,c(H+)增大 |
| C、N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| D、K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com