
【题目】等物质的量的氢气和氦气在同温同压下具有相同的( )
A. 原子数B. 分子数C. 密度D. 质量
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( ) 
A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32﹣向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,关系不正确的是( )
A.C3H8与C2H6互为同系物
B.![]() 与
与 ![]() 互为同系物
互为同系物
C.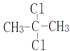 和
和 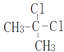 是同一种物质
是同一种物质
D.化学式为C5H10的有机物不一定能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中不存在碳碳单、双键的交替结构,下列可以作为证据的事实是( )
①苯不能使高锰酸钾酸性溶液褪色
②苯不能使溴水因发生化学反应而褪色
③苯在加热和有催化剂存在的条件下能还原成环己烷
④苯中碳碳键的键长完全相等
⑤邻二氯苯只有一种
⑥间二氯苯只有一种
A.①② B.①⑤
C.③④⑤⑥ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的同系物中,有的侧链能被KMnO4酸性溶液氧化,生成芳香酸,反应如下:

(1)现有苯的同系物甲、乙,分子式都是C10H14,甲不能被KMnO4酸性溶液氧化为芳香酸,它的结构简式是______________;乙能被KMnO4酸性溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有________种。
(2)有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种,试写出丙所有可能的结构简式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
(1)当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
(2)当铁炭混合物中铁的质量分数相同时,Cu2+的去除率比Pb2+的高,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为 4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O 研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 . 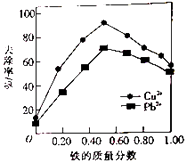
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.用灼烧的方法鉴别羊毛线和棉线
B.分馏石油时,温度计的水银球必须插入液面下
C.做银镜反应实验后,试管壁上的银镜用硝酸洗涤
D.沾附在试管内壁上的油脂,用热碱液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9C1O的同分异构体中能与Na反应放出氢气的共有(不含立体异构)( )
A.8 种
B.9 种
C.10 种
D.12 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1的稀H2SO4中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
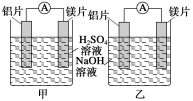
(1)写出甲池中发生的有关电极反应的反应式:
负极___________________________________,
正极___________________________________。
(2)写出乙池中发生的有关电极反应的反应式:
负极___________________________________,
正极___________________________________。
总反应离子方程式为_________________________。
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些结论?________。
A.利用原电池反应判断金属活动性顺序应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应条件多变,应具体问题具体分析
(5)上述实验也反过来证明了“利用金属活动性顺序表直接判断原电池中正、负极”的做法________(填“可靠”或“不可靠”)。如不可靠,则请你提出另一个判断原电池正、负极可行的实验方案____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com