
| 序号 | 实验事实 | 结论 |
| A | SO3的水溶液可以导电 | SO3是电解质 |
| B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
| C | Ca(ClO)2溶液中通入CO2产生白色沉淀 | 酸性:H2CO3>HClO |
| D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO3是非电解质;
B.能和硝酸酸化的氯化钡溶液反应生成白色沉淀的离子还有SO32-、Ag;
C.发生强酸制取弱酸的反应;
D.通过焰色反应检验钾离子时,观察火焰颜色时需要通过蓝色的钴玻璃观察.
解答 解:A.溶液导电,原因是SO3和水反应生成硫酸,SO3不能电离出离子,为非电解质,故A错误;
B.能和硝酸酸化的氯化钡溶液反应生成白色沉淀的离子有SO42-、SO32-、Ag+,故B错误;
C.将CO2通入Ca(ClO)2到溶液中产生白色沉淀碳酸钙,在溶液中发生强酸制取弱酸的反应,则酸性为H2CO3>HClO,故C正确;
D.实验室检验K+的存在用焰色反应,可以观察到紫色火焰,但要通过蓝色钴玻璃观察,以便滤去黄色光,避免干扰,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的检验和性质的比较,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸,并测得某溶液pH为3.1 | |
| B. | 中和pH与体积均相同的NaOH溶液和氨水,结果消耗H2SO4的物质的量一样多 | |
| C. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 | |
| D. | 在HCl气氛中蒸干AlCl3溶液能到得纯净的无水氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与足量氯气反应,1mol Fe失去电子数为3NA | |
| B. | 标准状况下,22.4LH2O所含的分子数为NA | |
| C. | 1molNH3所含原子数为NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
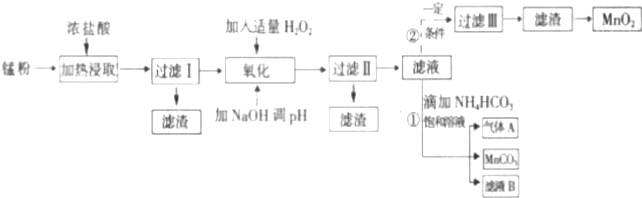
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com