
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |

���� ��1�������淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и��������ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��2���������¶ȣ�ƽ�������ȷ����ƶ������ݱ�������֪�������¶ȣ�ƽ�ⳣ����С��˵������Ӧ�Ƿ��ȷ�Ӧ��
���ȼ���COƽ����Ӧ���ʣ��ٸ���ͬһ���淴Ӧ��ͬһ��ʱ���ڷ�Ӧ����֮�ȵ��ڼ�����֮�ȼ���״���Ӧ���ʣ�COת����=$\frac{�μӷ�Ӧ��CO���ʵ���}{CO�����ʵ���}��100%$��
��3���ȼ���Ũ���̣�����Ũ������ƽ�ⳣ����Դ�Сȷ��ƽ���ƶ����Ӷ�ȷ�����淴Ӧ������Դ�С��
��4����Ϊ�����ܱ���������Ϊ��ѹ�ܱ����������ŷ�Ӧ���У����������ʵ�����С�����Լ���ѹǿ��С����Ϊ��ѹ���ȼ�ѹǿ���������з�Ӧ���ʴ��ڼף��ﵽƽ��״̬ʱ����COת���ʴ��ڼף��ҷ�Ӧ�ﵽƽ���ʱ��ȼ̣�
��� �⣺��1��a�����۷�Ӧ�Ƿ�ﵽƽ��״̬����������CO������������CH3OH��������ȣ����Բ��ܾݴ��ж�ƽ��״̬���ʴ���
b����Ӧǰ�����������֮�ͼ�С������Ӧ�ﵽƽ��״̬ʱ�����������ʵ������䣬���������ѹǿ���ٸı䣬���Ծݴ��ж�ƽ��״̬������ȷ��
c����Ӧ�������ʵ���֮�ͼ�С����ƽ����Է�������������������ƽ����Է�����������
ʱ���淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬������ȷ��
d��CH3OH��CO��H2��Ũ�����ʱ�÷�Ӧ��һ���ﵽƽ��״̬���뷴Ӧ��Ũ�ȼ�ת�����йأ����Բ��ܾݴ��ж�ƽ��״̬���ʴ���
��ѡbc��
��2�����ɱ�������֪�������¶�ƽ�ⳣ����С��˵������Ӧ�Ƿ��ȷ�Ӧ�����ʱ�С��0���ʴ�Ϊ������
�ڿ�ʼʱc��CO��=$\frac{2mol}{2L}$=1mol/L��v��CO��=$\frac{1-0.2}{10}$mol/��L��min��=0.08 mol/��L•min����ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ����Լ״���Ӧ����Ϊ0.08 mol/��L��min����
ƽ��ʱn��CO��=0.2mol/L��2L=0.4mol����COת����=$\frac{��2-0.4��mol}{2mol}$��100%=80%��
�ʴ�Ϊ��0.08��80%��
��3��Ũ����=$\frac{6}{0.5��{2}^{2}}$=3��2.041����÷�Ӧ���淴Ӧ�����ƶ�������v��������v���棩���ʴ�Ϊ������
��4����Ϊ�����ܱ���������Ϊ��ѹ�ܱ����������ŷ�Ӧ���У����������ʵ�����С�����Լ���ѹǿ��С����Ϊ��ѹ���ȼ�ѹǿ���������з�Ӧ���ʴ��ڼף��ﵽƽ��״̬ʱ����COת���ʴ��ڼף��ҷ�Ӧ�ﵽƽ���ʱ��ȼ̣������ҵ�ͼ��Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���� ���⿼�黯ѧƽ����㡢��ѧƽ��Ӱ�����ء���ѧƽ��״̬�жϵ�֪ʶ�㣬Ϊ��Ƶ���㣬���ؿ���ѧ�������жϼ�����������ֻ�з�Ӧǰ��ı��������������Ϊƽ��״̬���ж����ݣ�ע��Ũ�����뻯ѧƽ�ⳣ���жϷ�Ӧƽ���ƶ�����ķ�������Ŀ�Ѷ��еȣ�


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д� ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | ʵ����ʵ | ���� |
| A | SO3��ˮ��Һ���Ե��� | SO3�ǵ���� |
| B | ��ij��Һ�м���BaCl2��Һ��ϡHNO3�����а�ɫ�������� | ԭ��Һ�к�SO42- |
| C | Ca��ClO��2��Һ��ͨ��CO2������ɫ���� | ���ԣ�H2CO3��HClO |
| D | �ò�˿պȡij��Һ�ھƾ��ƻ���������ֱ�ӹ۲������ɫ��δ����ɫ | ԭ��Һ�в���K+ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʵ�������ָ���ʵ����� | |
| B�� | �����Ħ������Ϊ98g | |
| C�� | ��״���£�0.5mol CCl4�����Ϊ11.2L | |
| D�� | 20.00 mL 0.5 mol/L��Ca��NO3��2��Һ��NO3-�����ʵ���Ϊ0.02 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 44 8mL | B�� | 224 mL | C�� | 336mL | D�� | 0 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״�л���C5H7Cl����ṹ�п϶���һ��̼̼˫�� | |
| B�� | C8H10�DZ���ͬϵ�������3�в�ͬ�Ľṹ | |
| C�� | ������ϩ��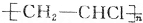 ������Է�������һ���Ⱦ���ϩ�� ������Է�������һ���Ⱦ���ϩ�� ���Ĵ�34.5n ���Ĵ�34.5n | |
| D�� | ����������Һ���������Ǻ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �Ҵ� | C�� | ���� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH2=CH-CH=CH2 1��3-����ϩ | B�� | 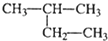 2-������ 2-������ | ||
| C�� | 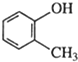 ������ ������ | D�� | 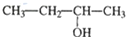 3-���� 3-���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com