
【题目】含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl-1.5 mol,K+和Na+共1.5 mol,Mg2+为0.5 mol,则SO42-的物质的量为
A. 1 mol B. 0.5 mol C. 0.25 mol D. 0.15 mol
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:

回答下列问题:
(1)写出所含物质的化学式:固体B_____,沉淀D_____。
(2)写出①、④两个反应的化学方程式:
①_______________________________________
④_______________________________________
(3)写出②、③两个反应的离子方程式:
②_______________________________________
③_____________________________________
(4)设计实验检验溶液F中所含溶质的阳离子:___________________________。
(5)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3︰_____________________________________
Fe2O3︰_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是( ) 
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)>c(CO32﹣)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( ) 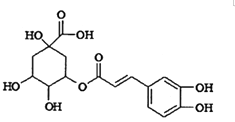
A.绿原酸分子中含有3种官能团
B.1 mol绿原酸最多能与7molNaOH发生反应
C.绿原酸能发生取代反应、加成反应和消去反应
D.绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,但反应原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某温度下,在Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=3.2×10﹣11)、AgCl(Ksp=1.8×10﹣10)三种物质中,溶解度最小的是
(2)在粗制CuSO45H2O晶体中常含有杂质Fe2+ . 在提纯时为了除去Fe2+ , 常加入氧化剂,使Fe2+氧化为Fe3+ , 下列物质最合适的是 A.KMnO4 B.H2O2 C.Cl2 水 D.HNO3
已知KMnO4氧化Fe2+时,生成Mn2+离子,试写出酸性KMnO4与Fe2+反应的离子反应方程式;然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A.NaOH B. NH3H2O C.CuCO3 D.Cu(OH)2
(3)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10﹣38 , Cu(OH)2的溶度积Ksp=3.0×10﹣18 , 通常认为残留在溶液中的离子浓度小于1×10﹣5 molL﹣1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL﹣1 , 则Cu(OH)2开始沉淀时溶液的pH为 , Fe3+完全沉淀时溶液的pH为(已知lg2=0.3,lg5=0.7),通过计算确定上述方案(填“可行”或“不可行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下: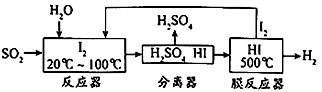
下列说法正确的是( )
A.分离器中的物质分离操作为过滤
B.膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2 = H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物分子中的基团之间存在着相互影响.
(1)在甲烷、苯、甲苯这三种物质中,可以使酸性高锰酸钾溶液褪色的有(填名称),能用于制取炸药梯恩梯(TNT)的是(填分子式).
(2)某学习小组通过实验探究①苯酚、②醋酸、③碳酸这三种物质分子中的羟基在水中电离能力的强弱.主要实验步骤如下: a、取三支试管,分别加入三种物质的水溶液(适量),再分别滴加2~3滴紫色石蕊试液,发现仅②、③的溶液变红.
b、另取一支试管,加入少量滴加了酚酞的NaOH溶液,再滴加①的溶液,发现试管中溶液的红色明显变浅.
c、再取一支试管,加入少量碳酸钠溶液,向其中滴加②的溶液,发现有气体生成.
d、将CO2气体通入苯酚钠的水溶液中,发现溶液变浑浊.
请回答以下问题:
①步骤b的现象说明苯酚具有性.
②步骤d中,发生反应的化学方程式为 .
③三种物质分子中的羟基在水中的电离能力由强到弱的顺序是(填序号).
④在苯酚分子中,羟基对苯基的性质也有影响.写出苯酚与浓溴水反应生成的有机产物的结构简式: .
(3)同学甲设计了如右图所示的实验装置一次性地验证苯酚、醋酸、碳酸的酸性强弱.同学乙认为该实验装置设计的不严密,理由是 . 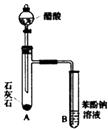
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。
(1)以丁烯和乙烯为原料制备丙烯的方法被称为“烯烃歧化法",主要反应为C4H8(g)+C2H4(g) ![]() 2C3H6(g)
2C3H6(g)
已知相关燃烧热数据:
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1411kJ·mol-1
C3H6(g)+ ![]() O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) △H3=-2539kJ·mol-1
①乙烯的电子式为。
②相同质量的C2H4(g)、C3H6(g)和C4H8(g)充分燃烧,放出的热量由多到少的顺序依次为(填写化学式)。
③ 上述“烯烃歧化法”的反应的热化学方程式为。
(2)“丁烯裂解法”是另一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。
反应如下:主反应:3C4H8 ![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 ![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示: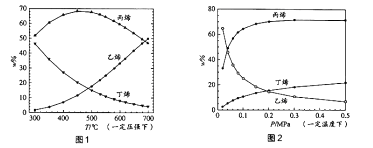
①平衡体系中的丙烯和乙烯的质量比[ ![]() ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是(填字母序号)
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是(填字母序号)
A. 300℃ 0.1MPa B. 700℃ 0.1MPa
C.300℃ 0.5MPa D.700℃ 0.5MPa
②有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是。
③图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,可大量共存的离子是( )
A. K+ Na+ OH- SO42-
B. Mg2+ SO42- NH4+ Cl-
C. K+ Na+ HCO3- Cl-
D. K+ Na+ NO3- CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com