
下列说法正确的是 ( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:填空题
Ⅰ. A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气体
④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族。
(2)C的原子结构示意图是 ,
A元素与D元素形成化合物的电子式是 。
(3)F的元素符号是 。
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 。
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
。
Ⅱ、(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(8分)选择以下物质填写下列空白:
A.氢氧化钠 B.氧化镁 C.He D.二氧化硅
E.氯化铵 F.碘晶体 G.二氧化硫 H.钾
(1)晶体中存在分子的是 。(2)晶体中既有离子键又有共价键的是 。
(3)融化时需要破坏共价键的是 。(4)最易溶于水的分子晶体是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:填空题
已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18):
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 _ __570 kJ(填“>”、“<”或“=”)。
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2气体和H2O(l)的热化学方程式为 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。
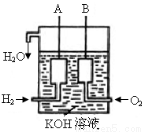
该电池的正极为:______(填A或B)。电极反应式为 ________ ____ 。
(4)若将上述装置中通入H2的改成CH4气体,也可以组成一个原电池装置,电池的总反应为:CH4+2O2+2KOH = K2CO3+3H2O ,则该电池的负极反应式为:______ _ _ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度,为了“减缓反应进行的速率,但又不影响生成H2的总量”,可向反应物中加入适量的 ( )
A.Na2CO3溶液 B.Na2CO3固体 C.水 D.NaNO3固体
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
下列关于化学反应速率的说法正确的是 ( )
A.化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8 mol /(L·s)是指1s 时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.决定反应速率的主要因素是反应物的浓度
查看答案和解析>>
科目:高中化学 来源:2013-2014福建安溪一中、惠安一中、养正中学下学期期中高二化学(解析版) 题型:填空题
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
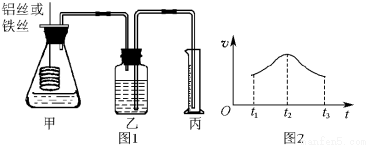
(1)检查图1所示装置气密性的方法是____________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量__________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建安溪一中、惠安一中、养正中学下学期期中高二化学(解析版) 题型:选择题
下列说法正确的是( )
A、需要加热才能发生的反应一定是吸热反应
B、化学反应中的能量变化都表现为热量变化
C、任何放热反应在常温下一定能发生反应
D、反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述中错误的是 ( )
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com