
Ⅰ. A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气体
④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族。
(2)C的原子结构示意图是 ,
A元素与D元素形成化合物的电子式是 。
(3)F的元素符号是 。
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 。
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
。
Ⅱ、(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素
(1)钠(1分) 三 ⅡA (1分)
(2)铝原子结构示意图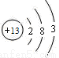 (1分)溴化钠电子式
(1分)溴化钠电子式 (1分)
(1分)
(3)He (1分)
(4) NaOH (1分) HBrO4 (1分) HF (1分)
(5)Al(OH)3+NaOH =NaAlO2+2H2O (3分)
Ⅱ、边界(1分)分界线(1分) F(1分) Cs(1分)

【解析】
试题分析:在同周期中,原子半径随原子序数的增大而减小。据题意可知A为钠B为镁C为铝。由室温时,D的单质是液体,E的单质是固体可知D为溴、E为硫.由F在常温下是气体,性质稳定,是除氢气外最轻的气体可知F应为氦。由G是除氢外原子半径最小的元素可知G应为氟。
考点:考查元素周期表相关知识的应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:简答题
(15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
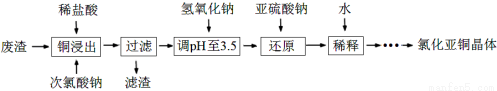
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ [CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的数值,下列说法正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2 NA时,阴极析出4 g金属
B.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA
C.常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L
D.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂。
已知Pb2+与这些离子形成的化合物的溶解度如下表:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为
A.硫酸盐 B.碳酸盐
C.硫化物 D.任何一种即可
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列物质的水溶液在适当加热时酸性增强的是
A.氯化铁 B.氯化钠 C.盐酸 D.碳酸钠
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
关于下列各组物质的相互关系,判断正确的是( )
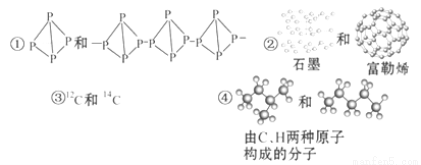
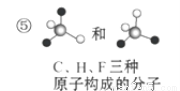
A.互为同素异形体的是①② B.互为同位素的是②③
C.互为同一物质的是①⑤ D.互为同分异构体的是④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列现象因发生加成反应而产生的是( )。
A.乙烯使酸性KMnO4溶液褪色
B.乙烯使溴的四氯化碳溶液褪色
C.将苯加入溴水中,振荡后水层接近无色
D.甲烷与氯气混合,光照一段时间后黄绿色消失
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:实验题
(16分)实验室模拟合成氨和氨催化氧化的流程如下:
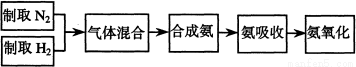
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式 。从下图中选择制取氮气的合适装置 。

(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 。

(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、 离子。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com