
关于下列各组物质的相互关系,判断正确的是( )
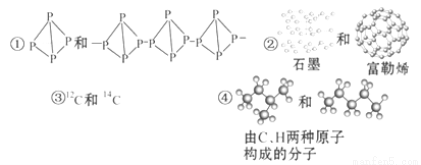
A.互为同素异形体的是①② B.互为同位素的是②③
C.互为同一物质的是①⑤ D.互为同分异构体的是④⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
密闭容器中,发生反应:CO(g) + 2H2(g) CH3OH(g) △H<0,下列说法正确的是
CH3OH(g) △H<0,下列说法正确的是
A.一定温度下,压缩容器体积,则正反应速率加快,逆反应速率减慢
B.若v生成(CH3OH)=v消耗(CO),则该反应达到平衡状态
C.升高温度,重新达到平衡时,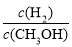 增大
增大
D.使用催化剂,反应的平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)将该温度下a mL pH=13 NaOH溶液与b mL0.05mol/L H2SO4混合,所得混合溶液的pH=7,
则a:b =
(2)若在含有足量AgCl固体的饱和AgCl溶液中分别放入:
A、100mL蒸馏水中; B、100mL 0.2 mol·L-1AgNO3溶液中;
C、100 mL 0.1 mol·L-1AlCl3溶液中; D、100mL 0.1 mol·L-1盐酸溶液中。
充分搅拌后,银离子浓度最小的是 (填序号)
(3)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11.00时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)=
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.0×10-20)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.HCN易溶于水
B.HCN溶液能导电
C.1mol/L氢氰酸溶液的pH约为3
D.10 mL1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:填空题
Ⅰ. A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气体
④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族。
(2)C的原子结构示意图是 ,
A元素与D元素形成化合物的电子式是 。
(3)F的元素符号是 。
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 。
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
。
Ⅱ、(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
既可用来鉴别甲烷与乙烯,又可除去甲烷中混有乙烯的最佳方法是( )
A.通入酸性高锰酸钾溶液中 B.通入足量溴水中
C.一定条件下通入H2 D.点燃
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列分子中所有原子都满足最外层8电子结构的是( )
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:选择题
将几滴KSCN(SCN-是“类卤离子”,与氯离子性质相似)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色。将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。
下列说法不正确的是
A.①红色褪去的原因可能是KMnO4将SCN-氧化,使[Fe(SCN)]2+消失
B.[Fe(SCN)]2+中Fe3+与SCN-以配位键结合。
C.②红色褪去的原因是SO2具有漂白性
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
下列关于化学反应速率的说法正确的是 ( )
A.化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8 mol /(L·s)是指1s 时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.决定反应速率的主要因素是反应物的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com