
��1�������¶���a mL pH=13 NaOH��Һ��b mL0.05mol/L H2SO4��ϣ����û����Һ��pH=7��
��a:b =
��2�����ں�������AgCl����ı���AgCl��Һ�зֱ���룺
A��100mL����ˮ�У� B��100mL 0.2 mol��L��1AgNO3��Һ�У�
C��100 mL 0.1 mol��L��1AlCl3��Һ�У� D��100mL 0.1 mol��L��1������Һ�С�
��ֽ����������Ũ����С���� ������ţ�
��3����25���£���Ũ�Ⱦ�Ϊ0.20 mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ�������� �������ѧʽ�������ɸó��������ӷ���ʽΪ ���������ҺpH=11.00ʱ������¶��²�������Һ�е�c(Mg2+):c(Cu2+)=
����֪25��ʱKsp[Mg(OH)2]=1.8��10-11��KsP[Cu(OH)2]=2.0��10-20��
��1�� 1��2�� C ��3�� 

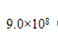
��������
�����������1���������֪������Ũ�ȵ�������������Ũ�ȣ�������������Ũ�����������ӻ�����10-14����10-13����0.1�����������ӵ����ʵ���Ϊ0.1a ���������ʵ���Ϊ0.05����2����b ����0.1b����a:b =1 ��2��Cѡ�������AgCl�ĵ��룬���Ȼ������ȵ�Ũ��������Դ�ѡC����3������Ŀ��֪������ͭ���ܽ�ƽ�ⳣ����С������������������ͭ ��
���㣺��������ƽ���ƶ����ܽ�ƽ������֪ʶ


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
50��ʱ�����и���Һ�У����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ����
A��pH=4�Ĵ����У�c��H+��=4��0molL��1
B������С�մ���Һ�У�c��Na+��= c��HCO3����
C������ʳ��ˮ�У�c��Na+��+ c��H+��= c��Cl����+c��OH����
D�� pH=12�Ĵ�����Һ�У�c��OH����=1��0��10��2mol?L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ĵ���У�����߿�ģ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
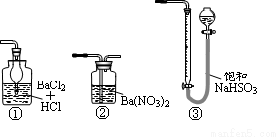
���и�ͼ��ʾװ�ã��϶�������������Ҫ�����( )
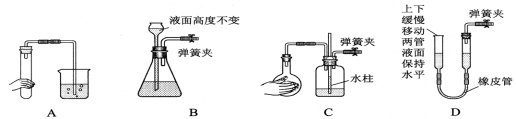
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ƽ�б�ҵ������������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��15�֣���ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ������SiO2����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ�ijͬѧ���������ʵ�飺
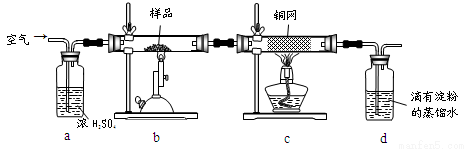
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.150g���ڿ��������½������գ�����Cu��Fe3O4��SO2���壬ʵ���ȡd����Һ��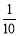 ������ƿ�У���0.05mol/L������Һ���еζ������ı���Һ20.00ml����ش��������⣺
������ƿ�У���0.05mol/L������Һ���еζ������ı���Һ20.00ml����ش��������⣺
��1��������Ʒ���õ�����Ϊ_____(�������ƽ��������ƽ��)������Ʒ��ϸ���ٷ�Ӧ����Ŀ����_______ ��
��2��װ��a��c�����÷ֱ���____��____�����ţ���
A��ȥSO2���� B��ȥ�����е�ˮ���� C������������
D�����ڹ۲�������� E��ȥ��Ӧ����������
��3��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ����___________��
��4��ͨ�������֪���û�ͭ��Ĵ���Ϊ________��
��5��������ͼװ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ�ĵ���____������ţ���
��6������ԭװ��d�е���Һ��ΪBa(OH)2����õĻ�ͭ�����Ϊ��1%������ʵ���������ȷ�����ܵ�ԭ����Ҫ��_____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ƽ�б�ҵ������������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ���������ֵ������˵����ȷ����
A����ʯī�缫���Ca(NO3)2��Һ����ת�Ƶ�����Ϊ0.2 NAʱ����������4 g����
B��0.1 mol24Mg32S������������������Ϊ2.8 NA
C�������º���NA��NO2��N2O4���ӵĻ������,�¶Ƚ�����״��,�����ԼΪ22.4 L
D��������״̬�£�1 mol NaHSO4��ȫ���������������ĿΪ2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾԭ��ع���ʱ���ҳ���Y2O72��ת��ΪY3+������������ȷ����
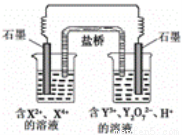
A����ص缫��Ӧʽ��X4+ + 2e��=X2+
B��ÿ����1mol Y2O72����ת��3mol����
C���ı��ҳ���Һ��c(H+)������ǿ�Ȳ���
D���������������Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ҫʹ��ҵ��ˮ�е��ؽ�������Pb2�����������������Ρ�̼���Ρ����������������
��֪Pb2������Щ�����γɵĻ�������ܽ�����±���
������ | PbSO4 | PbCO3 | PbS |
�ܽ��/g | 1.03��10��4 | 1.81��10��7 | 1.84��10��14 |
���������ݿ�֪��ѡ�õij��������Ϊ
A�������� B��̼����
C������ D���κ�һ�ּ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������и������ʵ����ϵ���ж���ȷ���ǣ� ��
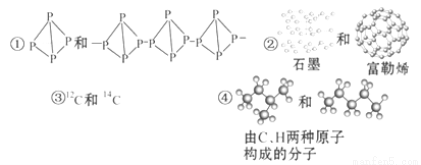
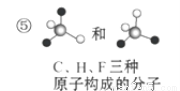
A����Ϊͬ����������Ǣ٢� B����Ϊͬλ�ص��Ǣڢ�
C����Ϊͬһ���ʵ��Ǣ٢� D����Ϊͬ���칹����Ǣܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ���ĵ���У����ѧ�ڵ����������߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ݱ����������⻯����NaBH4��BԪ�صĻ��ϼ�Ϊ+3�ۣ���H2O2��ԭ�ϵ�ȼ�ϵ�أ��������ϲ���Pt/C���������ϲ���MnO2���������վ�ͨ�����ǵ�Դ���乤��ԭ����ͼ��ʾ������˵����ȷ����
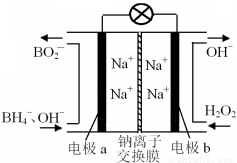
A����طŵ�ʱNa+��b��������a����
B���缫b����MnO2��MnO2�����缫�������д�����
C���õ�صĸ�����ӦΪ��BH4��+ 8OH��+8e����BO2��+ 6H2O
D��ÿ����3 mol H2O2��ת�Ƶĵ���Ϊ3 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com