
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0molL-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D. pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各项所述的数字不是6的是 ( )
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl- 的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在NaCl晶体中,与一个Cl-最近的且距离相等的Na+ 的个数
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三5月校质检理综化学试卷(解析版) 题型:填空题
[化学—有机化学基础](13分)
对甲基苯甲酸乙酯(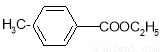 )是用于合成药物的中间体.请根据下列转化关系图回答有关问题:
)是用于合成药物的中间体.请根据下列转化关系图回答有关问题:
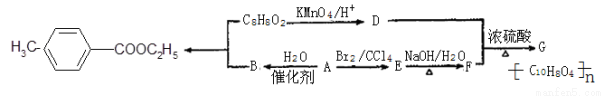 ·
·
(1)D中含有官能团的名称是 ,A-B的反应类型为 。
(2)G的结构简式为 。
(3)写出1种属于酯类且苯环上只有一个取代基的C8H8O2的同分异构体 。
丁香酚( )是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是 (填序号)。
)是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是 (填序号)。
A.NaOH (aq) B.NaHCO3(aq) C.酸性KMnO4(aq) D.FeCl3(aq)
(5)写出合成对甲基苯甲酸乙酯的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:选择题
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
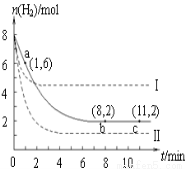
A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应?H>0
C.曲线Ⅱ对应的条件改变是降低压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
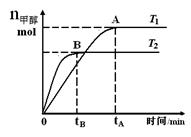
A.平衡常数K = 
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时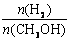 增大
增大
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在 5L密闭容器中进行,30秒后,NO的物质的量增加了0.3 mol,则此反应的平均速率v(x)(表示反应物的消耗速率或生成物的生成速率)为
A.v (O2)= 0.0l mol·L-1·s-1 B.v (NO)=0.002 mol·L-1·min-1
C.v (H2O)=0.003 mol·L-1·s-1 Dv (NH3)=0.001 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
密闭容器中,发生反应:CO(g) + 2H2(g) CH3OH(g) △H<0,下列说法正确的是
CH3OH(g) △H<0,下列说法正确的是
A.一定温度下,压缩容器体积,则正反应速率加快,逆反应速率减慢
B.若v生成(CH3OH)=v消耗(CO),则该反应达到平衡状态
C.升高温度,重新达到平衡时,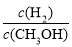 增大
增大
D.使用催化剂,反应的平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)将该温度下a mL pH=13 NaOH溶液与b mL0.05mol/L H2SO4混合,所得混合溶液的pH=7,
则a:b =
(2)若在含有足量AgCl固体的饱和AgCl溶液中分别放入:
A、100mL蒸馏水中; B、100mL 0.2 mol·L-1AgNO3溶液中;
C、100 mL 0.1 mol·L-1AlCl3溶液中; D、100mL 0.1 mol·L-1盐酸溶液中。
充分搅拌后,银离子浓度最小的是 (填序号)
(3)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11.00时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)=
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.0×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com