
【题目】在一固定容积的密闭容器中,进行反应:C(s)+H2O(g)![]() CO(g)+H2(g)。
CO(g)+H2(g)。
完成下列填空:
(1)若容器容积为2L,反应10s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为_________。
(2)若增加碳的量,则正反应速率________(选填“增大”、“减小”、“不变”)。
(3)该反应达到平衡状态的标志是_______(选填编号)。
a 压强不变 b ![]() (H2)=
(H2)=![]() (H2O) c c(CO)不变 D c(H2O)=c(CO)
(H2O) c c(CO)不变 D c(H2O)=c(CO)
(4)若升高温度,平衡向右移动,则正反应是______反应(选填“吸热”或“放热”)。
【答案】0.01mol/(Ls) 不变 ac 吸热
【解析】
(1)依据n=![]() ,c=
,c=![]() 计算氢气物质的量的变化量,依据V=
计算氢气物质的量的变化量,依据V=![]() 计算用V(H2),同一反应用不同物质表示的速率之比等于计量系数之比,计算V(CO);
计算用V(H2),同一反应用不同物质表示的速率之比等于计量系数之比,计算V(CO);
(2)化学反应中,改变固体或者纯液体的量,反应速率不变;
(3)可逆反应达到平衡状态,一定满足正逆反应速率相等且不为零,各组分的浓度不再变化;该反应的特点为:一是可逆反应;二是反应前后气体体积不相等,据此判断反应是否达到平衡状态;
(4)升高温度平衡向吸热反应方向移动。
(1)若容器容积为2L,反应10s氢气质量增加0.4g,则n(H2)=![]() =0.2mol,则△C=
=0.2mol,则△C=![]() =0.01 mol/(Ls);同一反应用不同物质表示的速率之比等于计量系数之比,即V(H2):V(CO)=1:1,所以V(CO)=0.01 mol/(Ls);
=0.01 mol/(Ls);同一反应用不同物质表示的速率之比等于计量系数之比,即V(H2):V(CO)=1:1,所以V(CO)=0.01 mol/(Ls);
(2)碳为固体,若增加碳的量,反应物浓度不变,反应速率不变;
(3)a.C(s)+H2O(g)CO(g)+H2(g)该反应为反应前后气体体积改变的反应,压强不变可以证明达到平衡,故a正确;
b.v正(H2)=v正(H2O),都表示正方向速率,无论是否达到平衡状态,同一方向,用不同物质表示的速率之比都等于计量系数之比,故b错误;
c.达到平衡后各物质浓度保持不变,所以当c(CO)不变可以判断反应达到平衡状态,故c正确;
d.c(H2O)=c(CO) 不能证明正逆反应速率相同,不能说明反应物、生成物浓度不变,不能证明反应达到平衡状态,故d错误;
故答案为ac;
(4)升高温度平衡向吸热反应方向移动,若升高温度,平衡向右移动,说明正方向为吸热反应。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】暖宝宝是市场上常见的热敷、止痛、消肿贴剂。它由原料层、明胶层、无纺布袋层三部分组成,其中原料是由铁、石墨、活性炭、无机盐等合成的聚合物,构成了原电池,其中铁作( )
A.负极B.正极C.阴极D.阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,4L H2和O2的混合气体爆炸后恢复到原来状态,其体积变为3L。则原混合气体中H2和O2的体积比可能为( )
A.1:2B.1:3C.3:1D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 为中学常见单质,其中一种为金属;通常情况下,A 为固体,B 为液体,C 为气体。D、 E、F、G、H、X 均为化合物,其中 X 是一种无氧强酸、E 为黑色固体,H 在常温下为液体。它们之间的 转化关系如图所示(其中某些反应条件和部分反应物已略去)。

(1)写出化学式:A____________、D__________、E__________、X________。
(2) 在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3) 反应⑥的离子方程式为__________。
(4)反应⑦的化学方程式为__________,该反应中每消耗 0.3molA,可转移电子__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、W 四种短周期元素的原子序数依次增大。其中 X 与 Y、Z、W 所形成的常见化合 物(10e 或 18e)在常温下均为气态,在元素周期表中 Z 与 W 相邻,Y 的最高价氧化物的水化物与其氢化 物反应生成盐,且 Y 的核电荷数与 W 的最外层电子数相同。
(1)Z 离子的结构示意图是_____。
(2) X、Y、W 可组成一种化合物,原子个数比为 4:1:1,该化合物的化学式是_____,其中含有的化学键 有_____。
(3)X 与 Y 所形成的分子的电子式为_____,它比同主族其他元素的氢化物沸点高的原因是______。
(4)请从 Z、W 的结构上说明 Z、W 两种元素非金属性的强弱_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有如图所示的实验装置:
A C
C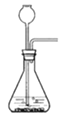 D
D E
E ![]() F
F
(1)已知氮气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,在实验室中通常用加热固体氯化铵和氢氧化钙的混合物来制取氨气。试回答下列问题:
①实验室制取氨气可以选用________装置,收集氨气可以选用________装置。
②试写出实验室制取氨气的化学方程式:____________________________________。
③如何检验收集的气体是氨气?试写出方法和结论:__________________________。
(2)甲、乙两组同学用干燥的圆底烧瓶各收集一瓶氨气,根据图B喷泉实验的装置进行实验,都观察到美丽的红色喷泉。
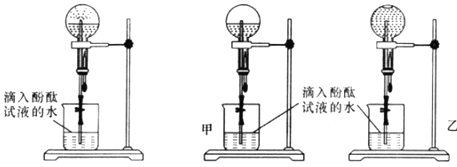
图B:喷泉实验装置 图C:两组实验结果对比
根据实验现象说明氨气具有的性质是___________、____________。
(3)甲、乙两组同学完成喷泉实验后,圆底烧瓶中所得溶液如图C所示。请通过分析确认:甲组同学所得氨水的物质的量浓度_______(填“大于”、“小于”或“等于”)乙组同学所得氨水的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如右图。下列说法中不正确的是( )

A. Y代表盐酸与镁条的反应
B. a点时反应Y消耗镁条的量少
C. b点表示此时两溶液pH相等
D. c点表示此时反应结束
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:
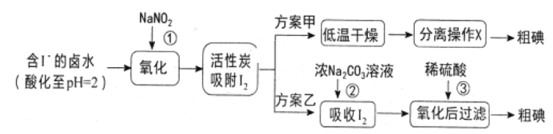
资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.5SO32-+2IO3-+2H+=I2+5SO42-+H2O;
Ⅳ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_________________________________________。
(2)方案甲中,根据I2的特性,分离操作X的名称是________________。
(3)已知:反应②中每吸收3molI2转移5mol电子,其离子方程式是_______________。
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是_______________。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._____________________________________________________________。
(6)某学生计划用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸450 mL。回答下列问题:实验过程中,不必使用的是________(填字母)。
A.托盘天平 B.量筒 C.容量瓶 D.250 mL烧杯 E.胶头滴管 F. 500 mL试剂瓶
(7)除上述仪器中可使用的以外,还缺少的仪器是______;在该实验中的用途是________________。
(8)量取浓盐酸的体积为______ mL,应选用的量筒规格为________。
(9)配制时应选用的容量瓶规格为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学设计实验探究碳、硅元素的非金属性的相对强弱,实验装置如图。根据要求完成下列各题。
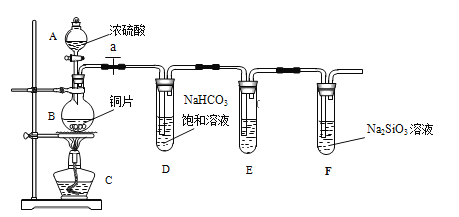
(1)填写所示仪器名称:A__________,B__________。
(2)实验步骤:连接仪器、______________、加药品后,打开 a、滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中装的是酸性KMnO4溶液,其作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com