
����Ŀ���Ӻ�ˮ�п�����ȡ�ܶ����õ����ʣ�����Ӻ�ˮ�������õ���±ˮ�п�����ȡ�⡣����̿�������ǹ�ҵ���ķ���֮һ�����������£�
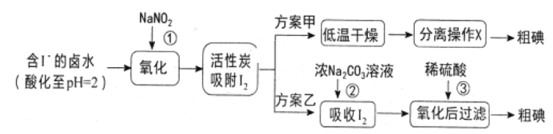
������ʾ����pH=2ʱ��NaNO2��Һֻ�ܽ�I-����ΪI2,ͬʱ����NO;
��I2+5Cl2+6H2O=2HIO3+10HCl;
��5SO32-+2IO3-+2H+=I2+5SO42-+H2O;
����I2�ڼ�����Һ�з�Ӧ����I-��IO3-��
(1)��Ӧ�ٵ����ӷ���ʽ_________________________________________��
(2)�������У�����I2�����ԣ��������X��������________________��
(3)��֪����Ӧ����ÿ����3molI2ת��5mol���ӣ������ӷ���ʽ��_______________��
(4)Cl2������KMnO4�ȶ��dz��õ�ǿ�����������ù���������±ˮ�е�I-ȴѡ���˼۸�ϸߵ�NaNO2,ԭ����_______________��
(5)�������У���֪��Ӧ�۹��˺���Һ���Դ���������I2��I-��IO3-����ֱ������Һ�е�I-��IO3-����ʵ�鷽������������ʵ���пɹ�ѡ����Լ���ϡH2SO4��������Һ��Fe2(SO4)3��Һ��Na2SO3��Һ
A����Һ��CCl4�����ȡ����Һ��ֱ��ˮ���õ�����Һ���鲻���ⵥ�ʴ��ڡ�
B��_____________________________________________________________��
(6)ijѧ���ƻ���12 mol��L��1��Ũ��������0.10 mol��L��1��ϡ����450 mL���ش��������⣺ʵ������У�����ʹ�õ���________(����ĸ)��
A��������ƽ��B����Ͳ��C������ƿ��D��250 mL�ձ� E����ͷ�ιܡ�F. 500 mL�Լ�ƿ
(7)�����������п�ʹ�õ����⣬��ȱ�ٵ�������______���ڸ�ʵ���е���;��________________��
(8)��ȡŨ��������Ϊ______ mL��Ӧѡ�õ���Ͳ���Ϊ________��
(9)����ʱӦѡ�õ�����ƿ���Ϊ______________��
���𰸡�2NO2-+2 I-+4H+ =I2+2NO+2H2O����������ȣ��������ᾧ���������ᾧ���۷֣�3I2+3CO32-=5I-+IO3-+3CO2 ����3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-�����������Ը�����صȶ��dz��õ�ǿ�����������������I2(���������ƽ��ܰѵ����������ɵⵥ�ʣ���˼�Լ���)��ˮ��ȡ������Һ���Թ��У����뼸�ε�����Һ���μ�Fe2(SO4)3��Һ������Һ������˵����Һ�к���I��������ˮ����ȡ������Һ���Թ��У����뼸�ε�����Һ���������ữ���μ�Na2SO3��Һ������Һ������˵����Һ�к���IO3��A������ϡ��Ũ����ʱ��������ã�ʹ��Һ��Ͼ��ȣ����ձ���ϡ�͵���Һת�Ƶ�����ƿ��ʱ����������4.210 mL500 mL
��������
(1)�������ƾ���������,�����Ӿ��л�ԭ��,���������¶��߷���������ԭ��Ӧ����һ�������͵��ˮ,���ӷ�Ӧ����ʽΪ2NO2-+2I-+4H+ =I2+2NO+2H2O����ȷ�𰸣�2NO2-+2 I-+4H+ =I2+2NO+2H2O��
(2)��������,�������У��������XΪ��������ȡ������ᾧ����ˣ�������ȷ����:��������ȡ������ᾧ��
(3)��Ӧ����ÿ����3molI2ת��5mol���ӣ�˵������I-��IO3-,������ӷ���ʽΪ: 3I2+3CO32-=5I-+IO3-+3CO2 ����3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-������ȷ�𰸣�3I2+3CO32-=5I-+IO3-+3CO2 ����3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-����
(4)���������Ը�����صȶ��dz��õ�ǿ������������������ⵥ�ʣ����������ƽ��ܰѵ���������Ϊ�ⵥ�ʣ��ʸù���������±ˮ�еĵ����ӣ�ѡ���˼۸�ϸߵ��������ƣ���ˣ�������ȷ���ǣ����������Ը�����صȶ��dz��õ�ǿ�����������������I2(���������ƽ��ܰѵ����������ɵⵥ�ʣ���˼�Լ���)��
(5)������Һ�еĵ����ӡ���������ӣ����õ����ӱ��������ɵⵥ�ʼ��飬��������ӱ���ԭ���ɵⵥ�ʼ��飬����Ϊ����ˮ��ȡ������Һ���Թ���,���뼸�ε�����Һ,�μ� Fe2(SO4)3��Һ,��,��Һ����,˵����Һ�к���I������ȡ��ˮ��ȡ������Һ���Թ���,���뼸�ε�����Һ,�������ữ,�μ�Na2SO3��Һ,����Һ������˵����Һ�к���IO3�� ����ȷ�𰸣���ˮ��ȡ������Һ���Թ��У����뼸�ε�����Һ���μ�Fe2(SO4)3��Һ������Һ������˵����Һ�к���I��������ˮ����ȡ������Һ���Թ��У����뼸�ε�����Һ���������ữ���μ�Na2SO3��Һ������Һ������˵����Һ�к���IO3�� ��
��6����Ũ��Һ����ϡ��Һʱ��Ӧѡ����Ͳ������������ƽ����ȷ�𰸣�A��
��7������һ��Ũ�ȵ�ϡ������Һ��ͨ����6����֪����ȱ�ٵ������Dz�����������ϡ��Ũ����ʱ��������ã�ʹ��Һ��Ͼ��ȣ����ձ���ϡ�͵���Һת�Ƶ�����ƿ��ʱ���������ã���ȷ�𰸣���������ϡ��Ũ����ʱ��������ã�ʹ��Һ��Ͼ��ȣ����ձ���ϡ�͵���Һת�Ƶ�����ƿ��ʱ���������á�
��8������ȡŨ��������ΪV mL������ϡ��ǰ��HCl���ʵ����غ㽨����ϵʽ��12 mol��L��1��V��10-3��0.10 mol��L��1��500 ��10-3��V��4.2 mL��������Ͳ�Ĺ��ѡȡ10 mL��Ͳ����ȷ�𰸣�4.2 ��10 mL��
��9������ϡ����450 mL������û�д��ֹ�������ƿ��������500 mL������ƿ����ȷ�𰸣�500 mL��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������ڷ�����Ӧ��3FeO(s)+H2O![]() Fe3O4(s)+H2(g)-Q��H2O��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��2minʱ���ı�һ���������ı��������
Fe3O4(s)+H2(g)-Q��H2O��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��2minʱ���ı�һ���������ı��������

A. ����n(H2O)B. ����n(H2)C. ����ѹǿD. �����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�̶��ݻ����ܱ������У����з�Ӧ��C(s)+H2O(g)![]() CO(g)+H2(g)��
CO(g)+H2(g)��
���������գ�
��1���������ݻ�Ϊ2L����Ӧ10s������������0.4g�����ʱ����һ����̼�ķ�Ӧ����Ϊ_________��
��2��������̼������������Ӧ����________��ѡ����������������С����������������
��3���÷�Ӧ�ﵽƽ��״̬�ı�־��_______��ѡ���ţ���
a ѹǿ���� b ![]() (H2)=
(H2)=![]() (H2O) c c(CO)���� D c(H2O)=c(CO)
(H2O) c c(CO)���� D c(H2O)=c(CO)
��4���������¶ȣ�ƽ�������ƶ���������Ӧ��______��Ӧ��ѡ������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ksp(CaSO4)=9��10-6��������CaSO4��ˮ�еij����ܽ�ƽ������ͼ��������������ȷ����

��a��c��������Ա�ʾCaSO4����ˮ���γɵı�����Һ����a���Ӧ��Ksp������c���Ӧ��Ksp����b���Ӧ����Һ���г������ɣ�����d����Һ����������CaCl2������Ա䵽c�㣻��d����Һͨ�������ܼ����Ա䵽c�㣻��������CaSO4����ˮ�ı�����Һ�У�c(Ca2+)��c(SO42-)�ij˻���Ӧ����������һ�㣻�������£���100mL����CaSO4��Һ�м���400mL0.01mol/L Na2SO4��Һ����ʹ��Һ��a���Ϊb��
A. 2�� B. 3�� C. 4�� D. 5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Y �����ڸ����ܹ�ѧ��֬�ĺϳɣ����ɻ�����X��2 ����ϩ������һ�������·�Ӧ�Ƶã�

�����йػ�����X��Y ��˵����ȷ����
A. X ����������ԭ��һ����ͬһƽ���� B. Y��Br2�ļӳɲ�������к�������̼ԭ��
C. X��Y������ʹ����KMnO4��Һ��ɫ D. X��Y�ķ�ӦΪ�ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ����ܷ�Ӧ�����ӷ���ʽΪ��2Fe3++Fe![]() 3Fe2+����ʵ�ָ÷�Ӧ��ԭ�����
3Fe2+����ʵ�ָ÷�Ӧ��ԭ�����
A. ����ΪCu������ΪFe�������ΪFeCl3��Һ
B. ����ΪC������ΪFe�������ΪFeSO4��Һ
C. ����ΪFe������ΪZn�������ΪFe2(SO4)3��Һ
D. ����ΪAg������ΪCu�������ΪCuSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪0.4molҺ̬�£�N2H4��������H2O2��Ӧ�����ɵ�����ˮ�������ų�256.65kJ��������
��1��д��H2O2����ʽ___��������Ӧ���Ȼ�ѧ����ʽ______��
��2����֪H2O(l)=H2O(g)����H=+44kJ��mol-1����16 gҺ̬��ȼ�����ɵ�����Һ̬ˮʱ���ų���������____kJ��
��3����֪N2(g)+2O2(g)=2NO2(g) ��H=+67.7 kJ��mol-1��N2H4(g)+O2(g)=N2(g)+2H2O (g)����H=-534 kJ��mol-1�����ݸ�˹����д������NO2��ȫ��Ӧ���ɵ�������̬ˮ���Ȼ�ѧ����ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ɫ����������Һ�����������Ƴɹ�����
A.NH4+��NO3-��Al3+��Cl-B.Na+��Fe3+��OH-��NO3-
C.MnO4-��K+��SO42-��Na+D.Ca2+��Mg2+��HCO3-��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Mgԭ������������Ϊ_____����Ӧ������________�����Ӷ���ʾ_____�ۣ� Fԭ������������Ϊ_____����Ӧ������__________�����Ӷ���ʾ_____�ۡ������������У�Fԭ�Ӻ� Mgԭ��ͨ��_____________���γ���8�����ȶ��ṹ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com